スフェロイドや関連する3次元 (3D) 細胞モデルは、組織構造や遺伝子発現、代謝プロファイルなどといったin vivoでの生物学的特徴をより正確に示すため、従来の2D細胞培養モデルの多くの限界を凌駕しており、研究者の間で急速に人気を集めています。この傾向は、特にがん研究において顕著であり、がんのスフェロイドモデルは、がん微小環境 (TME) 内の3D組織構造を模倣するために開発されています。スフェロイドの密になった腫瘍様の構造と、TME内の細胞間接触の複雑なネットワークをより正確に表現する能力は、主要ながんの特性を示す疾患状態の、生物学的プロセスに関連するモデルの作製を可能にしました。
図1に示すようなスフェロイドの場合、従来の生化学的アッセイや2次元細胞アッセイと組み合わせて用いることにより、研究者が生物学的プロセスをより包括的に評価するための新たな手法となるため、治療薬の有効性と安全性を評価するモデルとして検討されることが増えています。
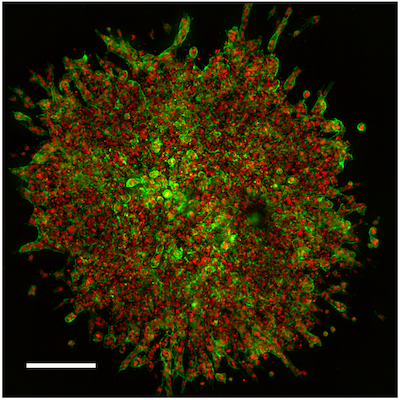 図1:Agilent BioTek Cytation C10共焦点イメージングリーダーで撮影した、HUVECスフェロイドを用いた3D血管新生出芽アッセイ。スケールバーは200 μmに相当します
図1:Agilent BioTek Cytation C10共焦点イメージングリーダーで撮影した、HUVECスフェロイドを用いた3D血管新生出芽アッセイ。スケールバーは200 μmに相当します
ハイスループットな薬物スクリーニングにおける3D細胞モデルの利用が増加していることから、スフェロイド内の生物学的な機能の調査用に設計された試薬に対し、3Dモデルでの使用に最適化されていることかどうかの確認を行う必要があります。免疫アッセイの場合、抗体のスフェロイドへの効果的な浸透と、標的エピトープへの特異的結合を確実にするため、プロトコールと試薬の両方を厳密に検証する必要があります。抗体の結合能、ひいては実験結果に影響を与える可能性がある因子は多く、サンプル調製、マトリックスと培養液の組成、スフェロイドの大きさと密度などがあります。
近年、CSTの科学者は、Agilent Technologies社とチームを結成し、Agilent社の最新鋭イメージング装置であるAgilent BioTek Cytation C10上で、CST®抗体を様々なアッセイに使用可能であることを実証しました。CSTとAgilent社が提供するこれらの2つの技術が、包括的かつ強力に機能することを実証するために、研究チームは、TGF-βシグナル伝達経路の活性化に対する細胞応答を、異なる生物学的スケール:生化学レベル、2Dの細胞レベル、3Dスフェロイドモデル (多細胞レベル) を用いて評価しました。
プロジェクトの概要は以下になります。詳細は、アプリケーションノート「血管新生におけるTGF-βシグナル伝達を定量的に評価するハイスループットな手法」をご覧ください。
TGF-β経路の活性化を評価する生化学モデル、2Dモデル、3Dモデルのアッセイ
TGF-β (Transforming growth factor-β) シグナル伝達経路は、増殖や分化、遊走などの基本的な細胞プロセスを制御する上で重要な役割を果たすため、結果として、動物の発生や健康、疾患における重要な役割を担います。TGF-βシグナル伝達の病的な変化は、がんや線維症、病的な免疫機能不全などの多くの疾患と関連します。
関連リソース:がんの特性の研究者向けガイド
TGF-βシグナル伝達は、様々な疾患と関連することが分かっているため、2023年の時点で約60件のTGF-βシグナル伝達が関係する臨床試験が活発に行われており、さらに、200件近くの臨床試験で患者を積極的に募集しています。
TGF-β経路の活性化を評価:SMADのリン酸化と移行
標準的なTGF-βシグナル伝達経路には、2つの主要なシグナル伝達軸のいずれかに属する受容体を活性化する、30種類以上のリガンドが存在します。一方の経路軸は、TGF-βリガンド-受容体相互作用を介して活性化され、もう一方はBMPリガンド-受容体相互作用を通じて活性化されます。
関連リソース:TGF-β/SMAD経路のインタラクティブパスウェイ図
いずれかの経路軸に属する受容体の活性化は、受容体の二量体化と自己リン酸化を引き起こし、それにより2つの経路軸の主要なシグナル伝達分子である、経路特異的受容体介在性のSMADタンパク質 (R-SMAD) のリクルートとリン酸化が誘導されます。そのため、SMADタンパク質のリン酸化は、リガンド-受容体相互作用に伴う経路活性化の確実かつ信頼性の高い指標として用いられます。
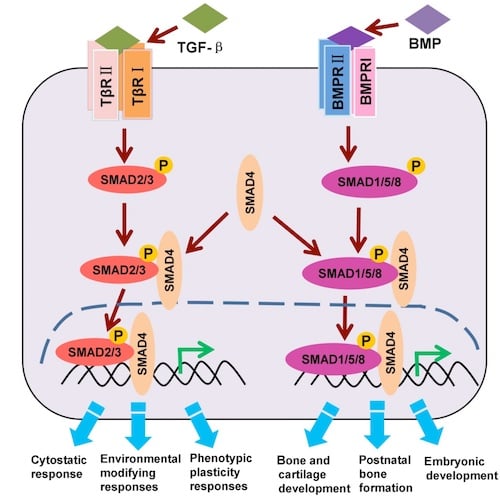 図2:標準的なTGF-β/BMP/SMADシグナル伝達経路
図2:標準的なTGF-β/BMP/SMADシグナル伝達経路
図2に示すとおり、SMAD2とSMAD3のリン酸化は、TGF-β経路軸の活性化を示し、SMAD1、SMAD5、SMAD9 (SMAD8と呼ばれることもあります) のリン酸化は、BMP経路軸の活性化を示します。いずれかの軸のSMADタンパク質がリン酸化されると、co-SMADであるSMAD4がリクルートされ、SMAD4は核に移行して標的遺伝子の転写を制御します。
TGF-β経路の活性化を評価する3つのアッセイ
生化学モデル、2D細胞モデル、3Dスフェロイドモデルという3種類のアッセイが、TGF-βとBMPのシグナル伝達経路の活性化の包括的な評価に使用できます。これらのアッセイは、SMADのリン酸化と誘導される機能的な結果の大きさを測定するものであり、どちらもリガンドの濃度と暴露時間に依存します。そのため、血管新生の促進や細胞増殖の抑制の評価に用いることができます。
Agilent BioTek Cytation C10は、自動化された共焦点顕微鏡と広視野顕微鏡の機能を、一般的なマルチモードマイクロプレートリーダーと組み合わせた、手頃な価格のベンチトップ共焦点イメージング装置です。スピニングディスク共焦点顕微鏡と広視野顕微鏡によるイメージング技術を組み合わせた独特な設計により、様々なサンプルにおける高解像度のイメージングと光学的セクショニング機能を実現します。
 図3Agilent BioTek Cytation C10共焦点イメージングリーダー
図3Agilent BioTek Cytation C10共焦点イメージングリーダー
各アプリケーションに特異的なCST抗体とBioTek Cytation C10を用いてTGF-β/BMPシグナル伝達を評価したところ、以下の結果が得られました:
生化学モデル
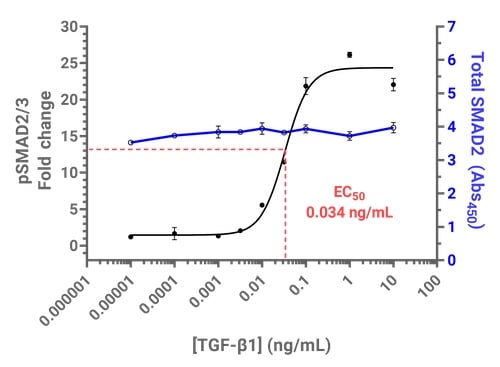 図4:TGF-β1が誘導するSMAD2/3のリン酸化は、Cytation C10のPathScan® ELISAキットを用いて測定できます。上図は、PathScan® Phospho-SMAD2 (Ser465/467)/SMAD3 (Ser423/425) Sandwich ELISA KitおよびPathScan® Total SMAD2/3 Sandwich ELISA Kit #12000を用いた、TGF-βに対するリン酸化SMAD2/3の用量応答曲線を示しています。
図4:TGF-β1が誘導するSMAD2/3のリン酸化は、Cytation C10のPathScan® ELISAキットを用いて測定できます。上図は、PathScan® Phospho-SMAD2 (Ser465/467)/SMAD3 (Ser423/425) Sandwich ELISA KitおよびPathScan® Total SMAD2/3 Sandwich ELISA Kit #12000を用いた、TGF-βに対するリン酸化SMAD2/3の用量応答曲線を示しています。
2D細胞モデル

図5:リン酸化特異的SMAD抗体と広視野イメージングにより、2D培養細胞における、TGF-β1が誘導するSMAD2/3のリン酸化と核移行のハイスループットな定量が可能になります。上図は、溶媒コントロール (A) またはTGF-β1で処理した細胞 (B) を固定し、Phospho-SMAD2 (Ser465/Ser467) (E8F3R) Rabbit mAb #18338 (緑) を用いて免疫染色した画像です。スケールバーは100 μmに相当します
3Dスフェロイドモデル
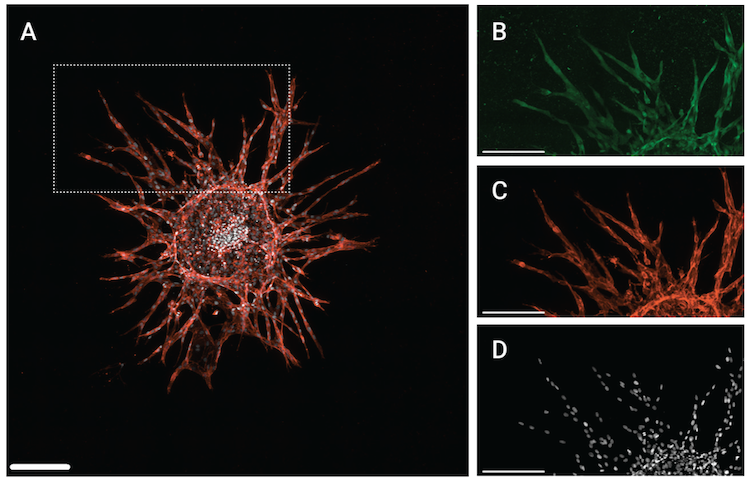
図6:3D発芽型血管新生モデルを用いて測定したSMAD4の発現を示しています。上図の (A) は、発芽型血管新生を持つHUVECスフェロイドの3×3モンタージュZスタック画像を最大値投影法で解析した結果を示しています。(B) - (D) は (A) の一部の領域を示しており、(B) はSMAD4 (D3R4N) XP® Rabbit mAb #46535を用いたSMAD4、(C) はCD31 (PECAM-1) (D8V9E) XP® Rabbit mAb #77699を用いたPECAM-1、(D) はDRAQ7 #7406を用いたDRAQ7のシグナルを示しています。スケールバーは200 μmに相当します
上図に示すように、スフェロイドモデルでは経路の活性化の評価にSMAD4抗体を、生化学モデルと2D細胞モデルではリン酸化SMAD抗体を用いました。SMAD4抗体は、3Dモデルにおいて、リン酸化SMAD抗体よりも良好なシグナル/ノイズ比を示したため、すべての試薬があらゆる状況において同等に機能するわけではないことが分かります。SMAD4は、TGF-β経路とBMP経路の両方でco-SMADとしてリクルートされることから、SMAD複合体の局在または局在変化の有用なマーカーとして機能します。
3Dモデルにおける免疫染色用抗体
In vitroモデル系は、生物学的プロセスを理解するために必要な基礎的ツールではありますが、in vivoでの生物学を再現できる範囲には限界があります。In vivoの組織構造をより良く反映する3Dスフェロイドモデルの活用は、潜在的な治療標的を同定し、薬剤の安全性を評価するための、より正確なスクリーニング環境を提供します。
高品質かつ各アプリケーションに特異的な抗体を、最先端のイメージング技術と共に活用することにより、生物学的プロセスを定量的に評価し、新しい治療法の開発の推進に必要なツールを提供できます。
その他のリソース
- SLAS2023ビデオプレゼンテーション: SMADシグナル伝達経路を定量的に評価するためのマルチスケールアプローチ
- 講演者: Antony Wood博士 (CST製品設計・戦略部門シニアダイレクター)、Ernest Heimsath博士 (Agilent Technologies Applications Development Scientist)
- インタラクティブパスウェイ図:
本ブログは、CSTの製品設計および戦略担当シニアダイレクターであるAntony (Tony) Wood博士にご協力いただいて作成しました。23-BPA-25500