アポトーシスとは何か?
アポトーシスは、プログラムされた細胞死 (Programmed cell death:PCD) の1つであり、細胞の収縮やクロマチンの凝縮、膜ブレブの形成、核の断片化といった特徴を示します。正常組織の形成と維持に不可欠であり、ほぼすべての生物における初期の胚発生では、アポトーシスにより不要な細胞が除去されています。また、アポトーシスは組織の恒常性においても重要であり、細胞集団内に含まれる古い細胞や損傷した細胞を除去して細胞の増殖と細胞死のバランスを調整しています。
アポトーシスが機能不全になると、非常に深刻な問題が生じます。アポトーシスが過剰な場合は、発達の異常や神経変性疾患を引き起こす可能性があり、逆にアポトーシスが不十分な場合は、損傷した細胞や不要な細胞が生き残ってしまうため、がんの進行や自己免疫疾患、慢性のウイルス感染が促進される可能性があります。
 |
CSTが提供する、アポトーシスやその他の細胞死用のAntibody Samplerキットを探索してください。
|
本ブログ記事では、アポトーシスに関与するメカニズムやシグナル伝達経路、タンパク質を解説します。また、正常組織および疾患組織におけるアポトーシスの役割の研究に役立つ主なアッセイやマーカーも紹介しています。
アポトーシスのメカニズム:内因性経路と外因性経路
アポトーシスは、明確な形態的変化や特定のカスパーゼおよびミトコンドリア制御経路の活性化を特徴とする、厳密に制御されたプロセスです。
アポトーシスの誘導には、主に2つのメカニズムが存在します:
 |
内因性ミトコンドリア経路は、細胞ストレスやDNA損傷、発生の開始、または生存因子の欠如により活性化されます。 » ミトコンドリアが制御するアポトーシス経路を探索する |
 |
外因性細胞死受容体経路は、細胞表面に発現する受容体への細胞死リガンド (例:FasLやTNF-α) の結合などといった、外因性の細胞死シグナルにより誘導されます。 » 細胞死受容体シグナル伝達経路を探索する |
内因性と外因性のどちらの経路も、複雑なシグナル伝達カスケードを活性化させながら、初期、中期、後期といった段階を経てアポトーシスを進行させます。各段階では、以下の重要なイベントが発生します:
- 初期段階:アポトーシス初期段階では、細胞死リガンドの結合やDISC複合体の形成 (外因性)、または細胞ストレスによるアポトーシス促進性Bcl-2ファミリータンパク質の活性化 (内因性) のどちらかが生じます。これは、ミトコンドリア外膜の透過化 (MOMP) を誘導し、BaxやBakなどのアポトーシス促進性タンパク質の活性化およびミトコンドリアへの局在の移行、Cytochrome cの放出、誘導型カスパーゼの活性化 (外因性であればCaspase-8、内因性であればCaspase-9) を促します。並行して、ホスファチジルセリンは形質膜の外葉に移行します。
- 中期段階: 実行型カスパーゼ (Caspase-3、Caspase-6、Caspase-7) が活性化されて、PARPやLamin A/Cなどの主要な基質の切断や細胞の収縮、細胞骨格の崩壊、クロマチンの凝縮、核の断片化が誘導されます。
- 後期段階: DNAの断片化、膜ブレブの形成、アポトーシス小体の形成が誘導されます。これらは、貪食細胞によって認識および貪食されます。
アポトーシスは、オートファジーやネクローシスなどの他のプログラムされた細胞死と共通した特徴や経路をいくつか有するため、細胞死の種類と段階を確認するには、複数のマーカーとアッセイが必要になります。以下のセクションでは、アポトーシスのメカニズムをより詳しく解説します。お客様の実験に最適な手法の特定にお役立てください。
アポトーシスの検出:主なマーカーとアッセイ
TUNELアッセイ
アポトーシス後期段階では、DNAは染色体をヌクレオソーム単位に切断するエンドヌクレアーゼによって断片化されます。そのため、これらのDNAは、電気泳動したゲル上ではラダー状に観察されます。また、このDNAの断片化は、アポトーシスをin situでモニタリングするTUNELアッセイの基盤になります。TUNELアッセイは、細胞死の検出に広く用いられる確実な手法です。TUNELアッセイでは、蛍光標識したdUTP修飾で断片化DNAの3’OH末端をラベルし、これらを免疫蛍光染色 (IF)、免疫組織科学染色 (IHC)、またはフローサイトメトリーで検出します。
図1は、マウス胚の発生過程にみられる断片化DNA (赤) を示しています。手の指の間の細胞がプログラムされた細胞死を起こして指を分離させる、アポトーシスの典型的な例です。
 図1. 凍結固定マウス胚 (E14.5) において、手の指の分離中にアポトーシスが起きる様子を低倍率 (左) および高倍率 (右) で示しています。TUNEL Assay Kit (Fliorescence, 594 nm) #48513 は、アポトーシスの特徴であるDNAの断片化を示す細胞 (赤) を明らかにできます。一方、リコンビナントモノクローナル抗体Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb #9664は、内因性アポトーシス経路が活性化している細胞 (緑) を明らかにできます。すべての核をDAPI #4083 (青) で染色し、細胞組織の全体像を示しています。
図1. 凍結固定マウス胚 (E14.5) において、手の指の分離中にアポトーシスが起きる様子を低倍率 (左) および高倍率 (右) で示しています。TUNEL Assay Kit (Fliorescence, 594 nm) #48513 は、アポトーシスの特徴であるDNAの断片化を示す細胞 (赤) を明らかにできます。一方、リコンビナントモノクローナル抗体Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb #9664は、内因性アポトーシス経路が活性化している細胞 (緑) を明らかにできます。すべての核をDAPI #4083 (青) で染色し、細胞組織の全体像を示しています。
しかし、DNAの断片化はネクローシスでも起こるため、TUNELアッセイをアポトーシスと他の細胞死を区別する指標として使用するのは避けるべきです。アポトーシスにおけるDNA断片化は、小さく、丸く、均一に分布するアポトーシス小体として観察される一方、ネクローシスにおけるDNA断片化は、より不規則で細胞の溶解を伴います。そのため、これらの区別には形態的な解析が役立ちます。
 |
CST TUNELアッセイキットは、簡便で使いやすく、培養細胞や組織、パラフィン包埋サンプルでアッセイ当日に結果を取得できます: • TUNEL Assay Kit (Fluorescence, 594 nm) #48513 |
細胞膜の変化の特性解析
アポトーシスを検出するもう1つの方法に、細胞膜の変化の可視化があります。注目すべきは、アポトーシスの初期と中期は細胞膜が無傷のままであり、周辺組織への傷害や炎症を防いでいる点です。つまり、アポトーシスの「細胞内のサイトカインや消化酵素が細胞外に放出されていない」という特徴が、他の細胞死と区別するのに役立ちます。
アポトーシスの特徴の1つに、細胞膜内のホスファチジルセリン脂質の細胞外への露出が挙げられます。これらの脂質は通常、細胞質に面する側の細胞膜に存在していますが、アポトーシスが起きると細胞表面に反転して細胞外空間に露出します。これが貪食細胞に対する「Eat Me」シグナルとなり、死細胞は除去されます。細胞膜上のホスファチジルセリン脂質に結合する能力を持つAnnexin Vは、しばしばアポトーシス初期段階のマーカーとして用いられます。しかし、Annexin Vは、ネクローシスにより溶解された細胞やアポトーシス後期段階で膜が透過化された細胞のホスファチジルセリンも染色するため、図2で示すように、Annexin V染色はPropidium iodide (PI) などの色素と組み合わせて行うことが重要です。PIは、蛍光DNA色素であり、ネクローシスやアポトーシス後期段階で細胞膜が損なわれた際にのみDNAを染色します。
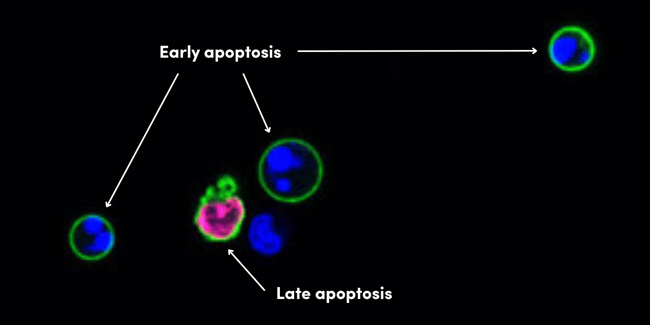
図2. アポトーシス誘導剤であるCamptothecinで処理したJurkat細胞の生細胞を、アポトーシス初期段階の特徴である「ホスファチジルセリンの露出」を示す細胞を染色するAnnexin V-FITC Early Apoptosis Detection Kit #6592 (緑) を用いて免疫蛍光染色して解析しました。Propidium iodide (赤) は、ネクローシスした細胞やアポトーシス後期段階にみられる膜が透過化された細胞を示します。DRAQ5® #4084 (青) は、すべての核DNAを示しています。
アポトーシスにおけるBcl-2ファミリータンパク質
内因性 (ミトコンドリア) アポトーシス経路は、進化的に保存された多くのシグナル伝達タンパク質を含んでおり、ミトコンドリアの完全性に依存しています。このプロセスは、アポトーシス促進性因子 (Bax、Bak、Bad、Bid、Puma、Bim、Noxa) とアポトーシス抑制性因子 (Bcl-2、Bcl-xL、Bcl-w、A1/Bfl-1、Mcl-1) からなるBcl-2ファミリータンパク質の活性のバランスによって厳密に制御されています。
アポトーシス促進性因子Bcl-2ファミリーのメンバーは、BaxやBakなどの複数のBcl-2相同 (BH) ドメイン (BH1、BH2、BH3) を有するマルチドメイン実行タンパク質と、BadやBid、Puma、Bim、NoxaなどのBH3ドメインのみを有するBH3-onlyタンパク質といった2つのグループに分かれます (注:Bidは、アポトーシスシグナルを増幅する外因性経路でも活性化されることがあります)。
これらの2つのグループとアポトーシス抑制性タンパク質との間の相互作用は、BHドメインに媒介されます。BH3-onlyタンパク質は、アポトーシス抑制性Bcl-2ファミリーメンバーと結合してその機能を抑制し、BaxとBakを活性化させてミトコンドリア外膜の透過化とアポトーシスを誘導します。
この相互作用は、BH3-onlyタンパク質の作用を模倣した低分子化合物であるBH3ミメティクスを用いたがん治療の標的となっています。例えば、Bcl-2阻害剤Venetoclaxは、アポトーシス抑制性Bcl-2ファミリータンパク質に結合し、アポトーシス促進性タンパク質を解放することによりがん細胞の細胞死を促進します。
 |
CSTが提供する、アポトーシスと細胞生存の促進に関連するAntibody Samplerキットを探索してください: • Pro-Apoptosis Bcl-2 Family Antibody Sampler Kit II #98322 |
|
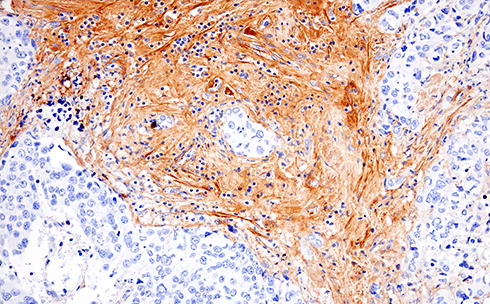
細胞ストレス時、または翻訳後修飾に応答して、BH3-onlyタンパク質は活性化してミトコンドリアに移動し、そこでマルチドメイン実行タンパク質であるBaxやBakと相互作用してこれらを活性化させます。図3のようなBimやBakといったアポトーシス促進性タンパク質とアポトーシスの共局在は、アポトーシス開始の特徴であり、細胞が自己破壊に向かう重要な段階にあることを示しています。
 図3. 上:リコンビナントモノクローナル抗体Bim (C34C5) Rabbit mAb #2933 (緑) を用いて免疫蛍光染色して解析したところ、BIMがミトコンドリアと共局在していることが分かりました。下:リコンビナントモノクローナル抗体Bak (D4E4) Rabbit mAb #12105 (緑) を用いて免疫蛍光染色して解析したところ、BAKがミトコンドリアと共局在していました。どちらの図も、MitoTracker Red CMXRos #9082 (赤) でミトコンドリアを、DRAQ5® #4084 (青) ですべての核DNAを染色しています。
図3. 上:リコンビナントモノクローナル抗体Bim (C34C5) Rabbit mAb #2933 (緑) を用いて免疫蛍光染色して解析したところ、BIMがミトコンドリアと共局在していることが分かりました。下:リコンビナントモノクローナル抗体Bak (D4E4) Rabbit mAb #12105 (緑) を用いて免疫蛍光染色して解析したところ、BAKがミトコンドリアと共局在していました。どちらの図も、MitoTracker Red CMXRos #9082 (赤) でミトコンドリアを、DRAQ5® #4084 (青) ですべての核DNAを染色しています。
BaxとBakは活性化すると、内因性 (ミトコンドリア) アポトーシス経路の特徴であるミトコンドリア外膜の透過化 (MOMP:Mitochondrial Outer Membrane Permeability) やCytochrome cの放出を誘導します。その後、細胞内を自由に動き回るCytochrome cは、Apaf-1と相互作用してアポトソーム (Apoptosome) と呼ばれる複合体を形成します。この複合体は、Caspase-9を活性化して、細胞を分解するためのアポトーシスイベントのカスケードを誘導します。
アポトーシスの検出には、ミトコンドリア膜電位を測定してMOMPの発生を検出するという方法もあります。このタイプのアッセイでは、TMRE (Tetramethylrhodamine ethyl ester perchlorate) などのミトコンドリア膜透過性蛍光色素を使用します。この色素は、正常な分極状態にあるミトコンドリアに蓄積します。アポトーシス初期段階にみられるミトコンドリア膜電位の喪失は、TMRE蛍光を減少させるためミトコンドリアの機能不全を検出できます。CSTのMitochondrial Membrane Potential Assay Kit (II) #13296には、TMREとコントロール化合物であるCCCPが含まれています。CCCPは、ミトコンドリアの酸化的リン酸化を阻害し、ミトコンドリア膜の脱分極を誘発します。
しかし、ミトコンドリア膜電位の喪失およびそれに伴うTMRE染色の減少は、ネクローシスにおいても起こりうるため、両者を区別するためには追加のアッセイが必要です。
アポトーシスにおけるカスパーゼの役割
内因性アポトーシス経路と外因性アポトーシス経路はどちらも、最終的にはカスパーゼの活性に依存します。カスパーゼは、プログラムされた細胞死に不可欠な役割を担うシステインプロテアーゼファミリーのメンバーです。カスパーゼは、機能に基づいて以下のように大まかに分類できます:
- 誘導型カスパーゼ:アポトーシス促進性シグナルに応答して活性化されるCaspase-2、 Caspase-8、Caspase-9、Caspase-10、Caspase-12などが含まれます。これらの誘導型カスパーゼは、活性化すると下流の実行型カスパーゼを切断して活性化させます。
- 実行型カスパーゼ:Caspase-3、Caspase-6、Caspase-7などが含まれます。アポトーシス時に、主要な構造タンパク質および制御タンパク質を切断することにより細胞を分解する役割を担います。
また、アポトーシスで機能するこれらのカスパーゼだけでなく、Caspase-1、Caspase-4、Caspase-5、Caspase-11といった特定のカスパーゼファミリーメンバーも、主に炎症や明らかにアポトーシスとは異なるプログラムされた細胞死であるパイロトーシスに関与します。
 |
関連するCST Antibody Samplerキットをご覧ください: • IAP Family Antibody Sampler Kit #9770 |
|
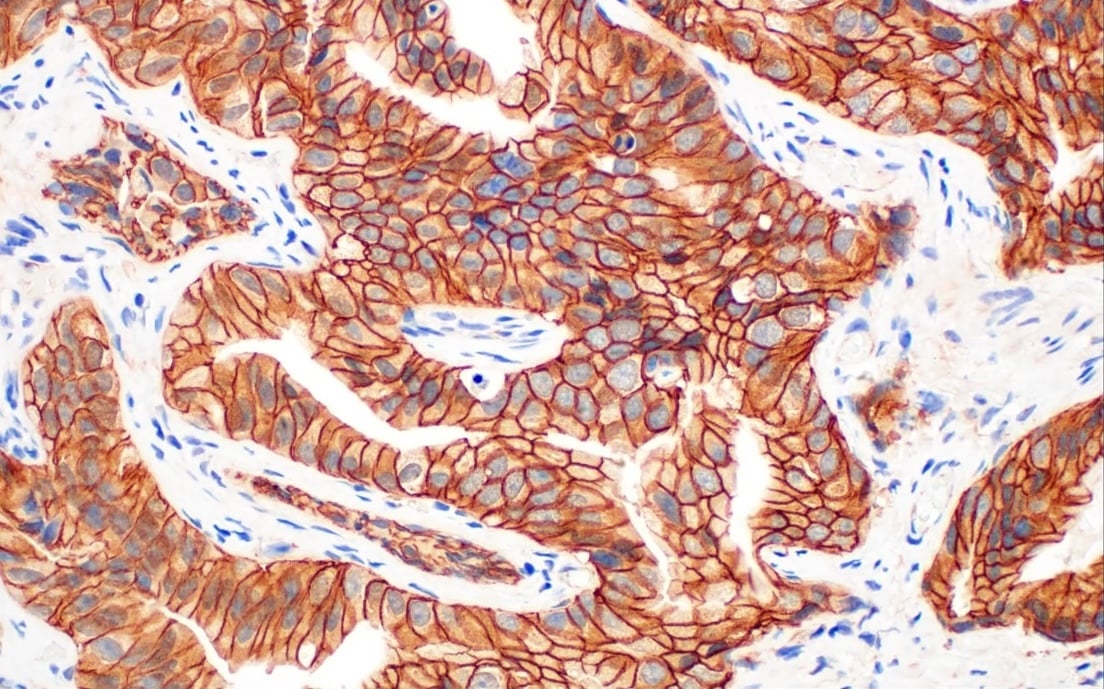
外因性経路では、細胞表面に発現する細胞死受容体のTNFRファミリー (FasやTNF-R1、TNF-R2、DR3、DR4、DR5) と、それらに関連する細胞外リガンド (TNF-α、FasL、TRAIL、TWEAKなど) が結合することによりによりカスパーゼが活性化されます。リガンドの結合がこれらの受容体の活性化を誘導し、DISC (Death Inducing Signaling Complex) が形成されます。この複合体が、誘導型カスパーゼであるCaspase-8をリクルートして切断し、活性化させます。図4に示すように、このCaspase-8の存在を確認することにより、細胞集団内でアポトーシスが起きるかどうかを確認できます。
 図4. パラフィン包埋ヒト類内膜腺がん組織を、Caspase-8 (F5K9P) Rabbit mAb #8873を用いて免疫組織化学染色 (IHC) して解析しました。この抗体は、全長および切断型のCaspase-8の両方を染色するため、これらの細胞内でCaspase-8依存型のアポトーシスが起きる可能性を確認できます。
図4. パラフィン包埋ヒト類内膜腺がん組織を、Caspase-8 (F5K9P) Rabbit mAb #8873を用いて免疫組織化学染色 (IHC) して解析しました。この抗体は、全長および切断型のCaspase-8の両方を染色するため、これらの細胞内でCaspase-8依存型のアポトーシスが起きる可能性を確認できます。
切断されたCaspase-8はその後、Caspase-3やCaspase-7などの実行型カスパーゼを切断して活性化させます。これらは、細胞基質の切断とアポトーシスに特徴的な形態学的変化を誘導します。活性化フォームである切断型カスパーゼおよびそれらの基質を標的とする特異的な抗体は、アポトーシス細胞死を特定するための重要なツールです。例えば、切断型Caspase-8の検出は、図5で示すように外因性経路を介したアポトーシス細胞死の主要なマーカーとなります。
 図5. 未処理 (左) またはTNF-αおよびCycloheximideで処理したRaw 264.7細胞を、外因性アポトーシスの特徴の1つであるCaspase-8の活性化が生じている細胞を標識するCleaved Caspase-8 (Asp387) (D5B2) XP® Rabbit mAb #8592 (緑) を用いて免疫蛍光染色し、解析しました。青の疑似カラーは、蛍光DNA色素であるDRAQ5® #4084の染色を示しています。
図5. 未処理 (左) またはTNF-αおよびCycloheximideで処理したRaw 264.7細胞を、外因性アポトーシスの特徴の1つであるCaspase-8の活性化が生じている細胞を標識するCleaved Caspase-8 (Asp387) (D5B2) XP® Rabbit mAb #8592 (緑) を用いて免疫蛍光染色し、解析しました。青の疑似カラーは、蛍光DNA色素であるDRAQ5® #4084の染色を示しています。
内因性経路では、Caspase-9が主な実行型カスパーゼです。細胞死受容体に依存する外因性経路とは異なり、内因性経路は上述のとおりBcl-2ファミリーのメンバーによるミトコンドリアの活性化に依存します。活性化したCaspase-9は、実行型カスパーゼを切断して活性化させるためのカスケードを刺激し、細胞の分解を誘導します。
図6に示すように、どちらの経路にも保存されている切断型PARP、切断型Lamin A/C、切断型Caspase-3は、カスパーゼ活性とアポトーシスの活性化を検出するための十分に確立されたマーカーです。
図6. 未処理のHT-29細胞 (左) またはStaurosporine #9953で処理したHT-29細胞 (右) を、リコンビナントモノクローナル抗体Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb #9664 (緑) で免疫蛍光染色して解析しました。アクチンフィラメントは、Alexa Fluor® 555 phalloidin #8953 (赤) で標識しています。青の疑似カラーは、蛍光DNA色素であるDRAQ5® #4084の染色を示しています。
IAPファミリータンパク質によるカスパーゼの阻害
XIAPやcIAP1、C-IAP2、NAIP、Livin、SurvivinなどのIAP (Inhibitor of Apoptosis)ファミリーに含まれるタンパク質は、様々なカスパーゼの活性を阻害してアポトーシスを防ぎます。
例えば、XIAPはCaspase-3、-7、-9に結合してその活性を阻害し、主要なアポトーシスタンパク質の切断を阻害します。IAPファミリーメンバーの発現は、細胞生存促進の指標となります。
IAPファミリーとカスパーゼ間の相互作用は、進化的に保存されるBIR (Baculoviral IAP repeat) ドメインを介して発生します。注目すべき点は、c-IAP1、c-IAP2、XIAPなどの一部のIAPファミリーメンバーは、ユビキチンE3リガーゼ活性を与えるRINGドメインも有するところです。これらのタンパク質は、RINGドメインを介して、主要なシグナル伝達タンパク質 (代表的なTNF細胞死受容体経路のタンパク質を含む) をユビキチン化し、その分解を促進することで、細胞死と炎症の両方を制御します。
外因性細胞死受容体経路は、TNFR2を介してNF-κBにシグナルを伝えることで、生存に寄与するBcl-2やFLIPの遺伝子発現を誘導することもできます。
その他のリソース
様々なタイプの細胞死のメカニズムや形態、主要なタンパク質についての詳細は、以下のガイドをダウンロードしてご覧ください。
細胞死のメカニズムシリーズのその他のブログ記事もご覧ください:
参考文献
- Dickens LS, Powley IR, Hughes MA, MacFarlane M. The 'complexities' of life and death: death receptor signalling platforms. Exp Cell Res. 2012;318(11):1269-1277. doi:10.1016/j.yexcr.2012.04.005
- Favaloro B, Allocati N, Graziano V, Di Ilio C, De Laurenzi V. Role of apoptosis in disease. Aging (Albany NY). 2012;4(5):330-349. doi:10.18632/aging.100459
- Diepstraten ST, Anderson MA, Czabotar PE, Lessene G, Strasser A, Kelly GL. The manipulation of apoptosis for cancer therapy using BH3-mimetic drugs. Nat Rev Cancer. 2022;22(1):45-64. doi:10.1038/s41568-021-00407-4
- McIlwain DR, Berger T, Mak TW. Caspase functions in cell death and disease [published correction appears in Cold Spring Harb Perspect Biol. 2015 Apr;7(4). pii: a026716. doi: 10.1101/cshperspect.a026716]. Cold Spring Harb Perspect Biol. 2013;5(4):a008656. Published 2013 Apr 1. doi:10.1101/cshperspect.a008656
- Shamas-Din A, Kale J, Leber B, Andrews DW. Mechanisms of action of Bcl-2 family proteins. Cold Spring Harb Perspect Biol. 2013;5(4):a008714. Published 2013 Apr 1. doi:10.1101/cshperspect.a008714
本ブログ記事は、初版が2021年3月に公開され、2025年6月に改訂されています。20-CEP-9437 and 25-HMC-18550