免疫蛍光染色 (IF) を実施する場合、複数の抗体や色素を用いてマルチプレックス (多重染色) を行い、目的のタンパク質とほかのマーカーの関連情報を得るのが一般的です。IFのテクニカルサポートチームに寄せられるお問合せの大半が、最もよく使われるマーカーである細胞内マーカーに関するものです。
細胞内マーカーとは何か
まず、細胞内マーカーとは何でしょうか?細胞内マーカーは、細胞内のオルガネラに特異的な成分に高い親和性をもつ試薬で、様々なオルガネラの物理的、空間的な特性を視覚的に明らかにして、研究に役立てることができます。特殊なオルガネラの特異的な機能や、オルガネラの健康を指標とする薬物効果の評価、ノックアウト細胞における全体的な変化の研究など、免疫蛍光染色実験における細胞内マーカーの用途は多様です。
目的のタンパク質に特異的な試薬と並行して、細胞内局在を決定するための試薬として用いる場合もあります。しかし、全ての試薬が普遍的に適用できる訳ではありません。モデル生物種や染色プロトコールによって、試薬の性能が異なる場合があります。皆様の実験ニーズに合った細胞内マーカーの選定をサポートするため、本ガイドを作成しました。
細胞内局在の決定:実験デザイン
本実験では、細胞骨格、ミトコンドリア、小胞体、ゴルジ体、核膜の5つの主要な細胞内局在に着目しました。
非常に特異性の高いマーカー (初期エンドソームのRab5、中心小体のPCM1など) や、より迅速に局在を標識する手法があるもの (DAPI #4083やPropidium Iodide #4087を用いた核染色など) は、ここでは省略しています。
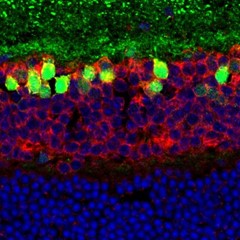
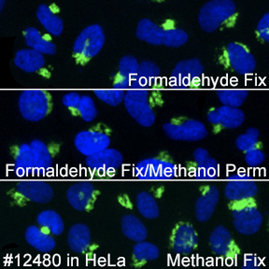
ProLong® Gold Antifade Reagent with DAPI #8961、Neurogranin #79519、S6 #5548で染色したマウス網膜
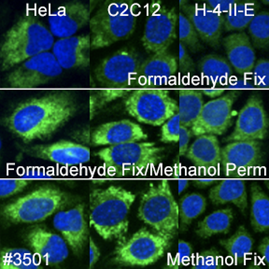
本解析では遍在するマーカーのみを検討しました。また、今回の実験で用いた試薬は、ヒト、マウス、ラット検体を用い、免疫蛍光染色でCell Signaling Technologyが採用している3つの主要なワークフロー (ホルムアルデヒドによる固定とTriton X-100による透過化、ホルムアルデヒドによる固定とメタノールによる透過化、メタノールによる固定) で検討しました。
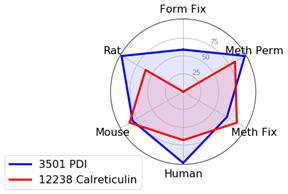
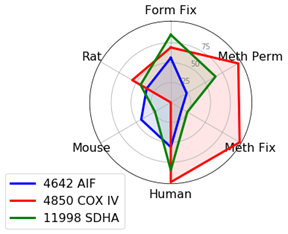
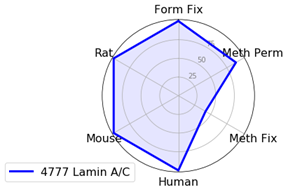
局在性の検討で抗体を比較し、所定のプロトコールや生物種で最適なマーカーを特定するため、特異性とシグナル強度の2点を評価基準としました。生物種やプロトコール間で性能を比較するため、局在を最も高性能に示したものを基準に標準化し、0 - 100の尺度で評価しました。こうすることで、複数の項目をレーダーチャートで比較することができます (例として、下図に飲料の比較を示しました)。
特定の生物種やプロトコールで非特異的なパターン (ミトコンドリアマーカーで核小体が標識されるなど) がみられる製品を推奨することを避けるため、非特異的なパターンが観察された場合はその製品の評価を0としました。
本試験では、抗体希釈液100 µLを用いて推奨希釈率に調整した各抗体を、96ウェルプレートの1ウェルを用いて3回試験しました。一次抗体は4°Cで一晩インキュベートしました。1:500で希釈した、宿主種に適したAlexa Fluor®488標識二次抗体 (Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) #4412またはAnti-mouse IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 488 Conjugate) #4408) を用いて一次抗体を標識しました。二次抗体は、暗所かつ室温で1時間インキュベートしました。96-ウェルプレートは、MFIデータを作成できるレーザースキャンイメージサイトメーターや、DAPIとAlexa 488チャンネルの200倍拡大画像を取得できる自動撮影装置などのハイコンテント解析を用いて解析しました。
結果
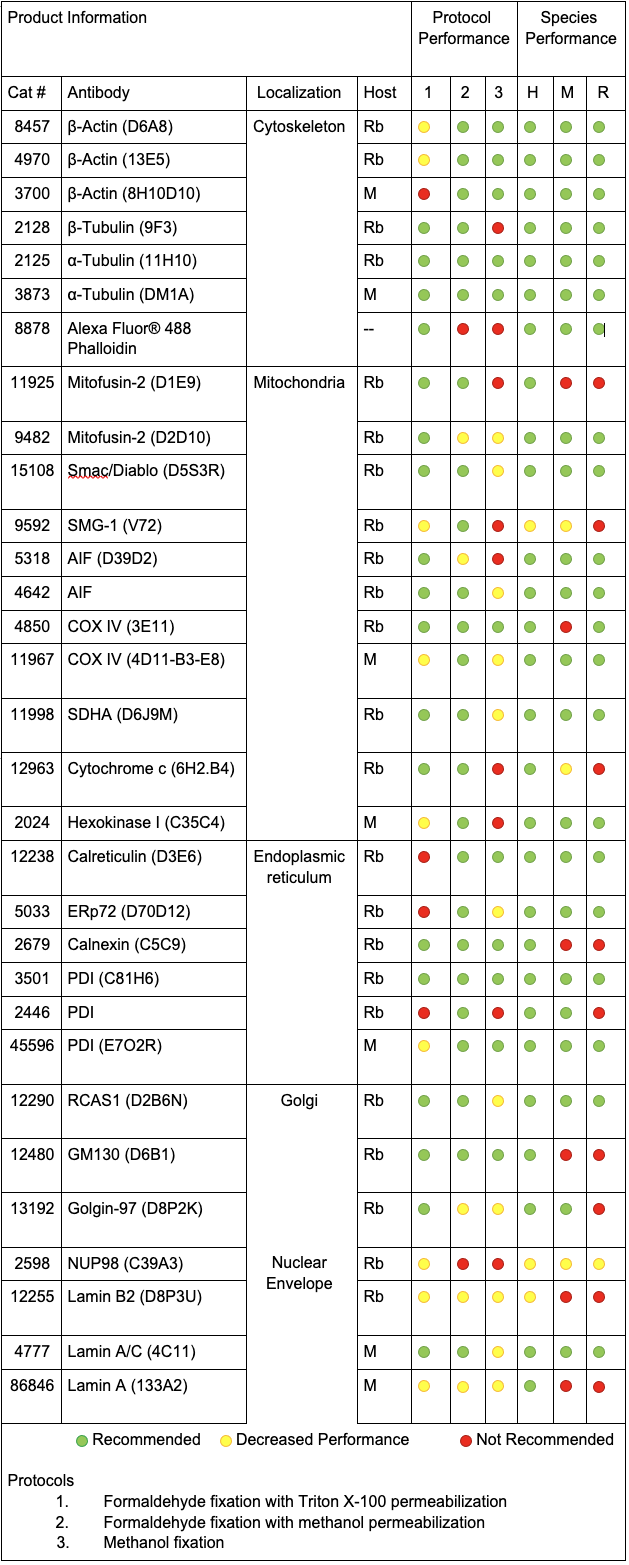
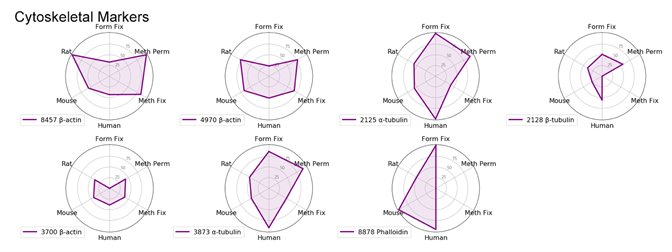
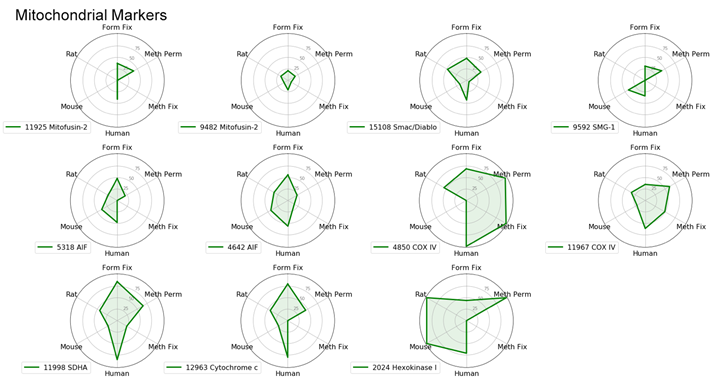
製品の性能を細胞内局在ごとにレーダーチャートで比較することで、各カテゴリーごとに最も効率よく細胞内局在を示すものを特定することができました。ここでは各細胞内局在を最も効率よく示したものの詳細を紹介し、全てのレーダーチャートを最後に掲載しました。
細胞骨格マーカー
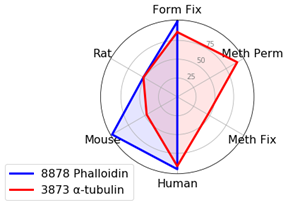
細胞骨格マーカーを使用する場合は、実験の柔軟性が最も高くなるPhalloidin (線維状のActinに強固に結合するPhallotoxin) をお勧めします。これは抗体に依らない標識法であるため、ほかのマーカーの宿主生物種を自由に選択することができます。ただし、Phalloidinにはメタノールによる透過化や固定には適さないという欠点があります。
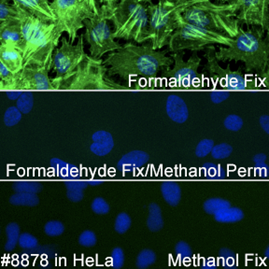
実験でメタノールを用いる必要がある場合には、安定したシグナルが得られるα-Tubulin (DM1A) Mouse mAb #3873をお勧めします。
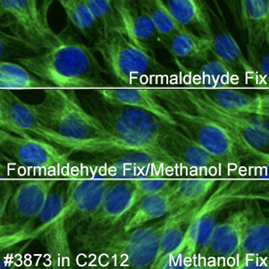
Tubulinは、Actin (微小線維) とは異なる細胞骨格の構成因子 (微小管) を標識することにご注意ください。3番目の細胞骨格の構成因子である中間径フィラメントは、細胞タイプによって異なるタンパク質を含むため本実験から除外しました。
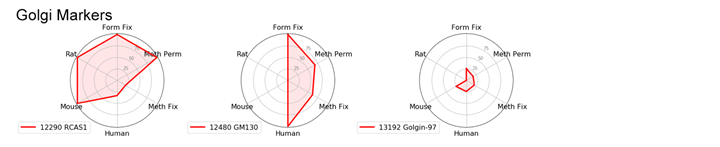
ゴルジ体マーカー
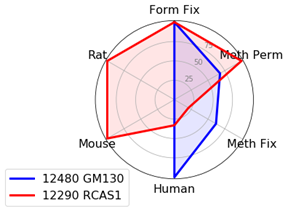
ゴルジ体マーカーは、ホルムアルデヒドで固定してTriton™ X-100で透過化するプロトコールで良好な結果が得られる傾向があります。しかし、ヒト検体を扱う場合には、GM130 (D6B1) XP® Rabbit mAb #12480を用いることでプロトコールを柔軟に選択することができます。
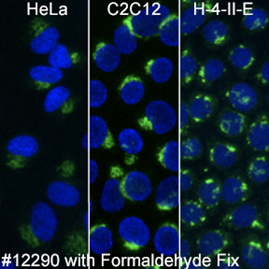
ホルムアルデヒドで固定した場合には、RCAS1 (D2B6N) XP® Rabbit mAb #12290が複数の生物種で機能します。
小胞体 (ER) マーカー
通常、ERに特異的なタンパク質を扱う場合は、ホルムアルデヒド固定化またはメタノールによる透過化を伴うホルムアルデヒド固定化の試験を推奨します。しかし本実験では、PDI (C81H6) Rabbit mAb #3501はすべてのプロトコールと生物種で良好な結果が得られました。
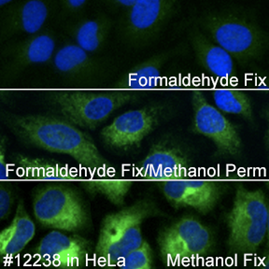
Calreticulin (D3E6) XP® Rabbit mAb #12238は、ホルムアルデヒド固定のみの場合には適さず、固定後にメタノールで透過化するかメタノールで固定する必要があります。
ミトコンドリアマーカー
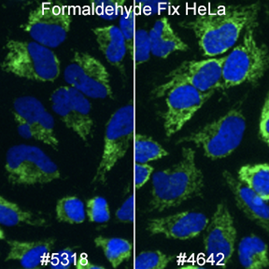
ミトコンドリアのマーカーとして使用できるものは多くあります。AIF (D39D2) XP® Rabbit mAb #5318は、多くの生物種やプロトコールに適合するため、Cell Signaling Technology®の社内試験によく用いられます。シグナルの強さに関しては、#5318よりAIF Antibody #4642の方がやや優れていますが、弊社は社内試験にXP®モノクローナル抗体を好んで用いています。
メタノール固定が必要で、生物種がヒトまたはラットの場合は、AIF抗体よりCOX IV (3E11) Rabbit mAb #4850の方が良好な結果が得られる可能性があります。
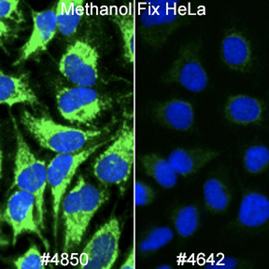
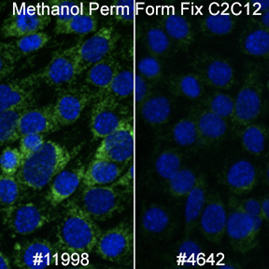
マウス細胞を扱う場合、メタノールで透過化したサンプルで、SDHA (D6J9M) XP® Rabbit mAb #11998の方がAIF抗体よりやや良好な結果が得られます。
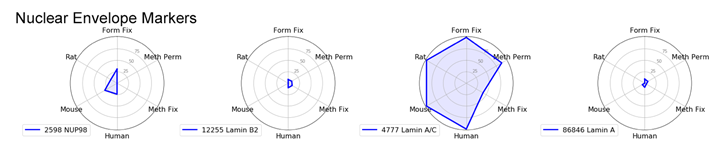
核膜マーカー
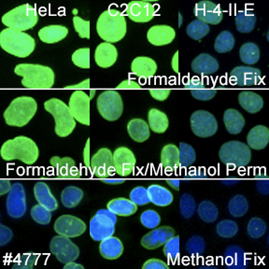
核膜マーカーの場合は、際立って優秀な製品があります。Lamin A/C (4C11) Mouse mAb #4777はすべての生物種で良好な結果が得られ、メタノール固定でやや減弱するものの、ほぼすべてのプロトコールで、明瞭で明るいシグナルが観察されました。
開始前のヒント
以上、それぞれの細胞内局在において最も高い性能がみられたものをご紹介しました。
どのような場合でも、実験を成功させるために最も重要な要因はサンプルを注意深く扱うことです。固定する前に細胞の健康状態や密度を考慮することが実験に影響を与えます。サンプルが十分に固定されていることを確認し、サンプルの乾燥は免疫蛍光染色実験に悪影響を及ぼす可能性があるので十分に注意してください。