ネクローシス性細胞死というと、昔のホラー映画のようなイメージを思い浮かべるかもしれませんが、細胞生物学の多くのプロセスと同様に、よく調べてみると、より魅力的で複雑なものになっています。
ネクローシス
ネクローシス (壊死) は、古くから化学的あるいは物理的な傷害に応答した、プログラムされない細胞死として定義されています。このような偶発的な細胞死の原因となる外的要因には、極端な物理的な温度や圧力、化学的ストレス、浸透圧ショックなどがあります。細胞の破裂はネクローシスの特徴であり、細胞の内容物が細胞外に漏出する原因でもあります。これにより、ダメージ関連分子パターン (DAMPs: Damage-Associated Molecular Patterns) と呼ばれる生体分子が放出され、これが免疫細胞に認識されて炎症反応が引き起こされます。
ネクローシス性細胞死のインタラクティブパスウェイ図を見る
ネクローシスは受動的で、プログラムされない細胞死であると考えられてきましたが、近年の研究によってネクローシスに類似した、カスパーゼとは独立のプロセスを経るプログラムされた細胞死の存在が明らかになってきました。ネクロプトーシスと呼ばれるプログラムされたネクローシスは、外因性刺激 (デスレセプター-リガンドの結合) 、内因性刺激 (微生物由来の核酸) のどちらによっても誘導される場合があり、カスパーゼ活性によって阻害されます。
同様に、パイロトーシス、フェロトーシス、ネトーシス (NETosis) など、タイプの異なるプログラムされたネクローシス性細胞死もありますが、これらは今後のブログで取り扱います。ネクローシス性細胞死、特にプログラムされたプロセスは、炎症性自己免疫疾患、繊維症のほか、アルツハイマー病 (AD)、多発性硬化症 (MS)、筋萎縮性側索硬化症 (ALS) を含む神経変性関連疾患など、多くの疾患の病態に関与しています。
ネクロプトーシス
ネクロプトーシスは制御された形態のネクローシスで、アポトーシスが阻害された場合に活性化される細胞の自己破壊のプロセスです。これはアポトーシスや他のプログラムされたネクローシス性細胞死とは異なり、カスパーゼ活性に依存することなく進行します。カスパーゼ活性に代わり、RIPK3依存性のMLKLのリン酸化が必要となります。このリン酸化により、MLKLは細胞膜に小孔複合体 (pore-complex) を形成し、DAMPsの分泌、細胞の膨潤、膜の破裂を引き起こします。ネクロプトーシスでは、細胞内小器官の膨潤や細胞膜の破裂といった細胞破壊の様々な段階がみられ、最終的に細胞質と核の崩壊がみられます。
ネクロプトーシスは本来、免疫原性が高く、病原体に対する宿主の防御機構として有用です。ウイルスの機構によってアポトーシスが阻害された場合にネクロプトーシスが起こることが示されており、これによって細胞が自己破壊を行い、ウイルスの複製を制限すると考えられます。ネクロプトーシスはこのほか、虚血脳障害、心筋梗塞、化学療法に伴う細胞死などの病態においても検出され、炎症性疾患、神経変性、がんにおいても活性化されます。
ネクロプトーシスはしばしば、TNF-αが細胞膜上のデスレセプター (DRs)に結合した場合など、細胞外刺激により引き起こされます。このTNFスーパーファミリー受容体には、TNFR1、Fas/CD95、DR4/TRAIL-R1、 DR5/TRAIL-R2などがあります。これらの受容体が活性化されると、アダプタータンパク質TRADDやTRAF2が結合し、下流のRIPキナーゼが活性化されます。
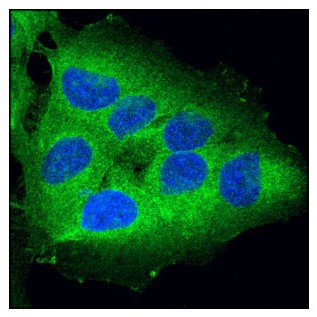
RIPキナーゼは、炎症や細胞死を調節するSer/Thrキナーゼです。上の図では、OVCAR8細胞をRIP (D94C12) XP® Rabbit mAb #3493 (緑) を用いて免疫蛍光染色し、共焦点顕微鏡で解析しました。
一般的に、RIPK3はRIPK1と複合体を形成した後、Ser227 (マウスではThr231/Ser232) がリン酸化されて活性化されます。RIPK1自身はSer166、 Ser161、Ser14/15を自己リン酸化します。この複合体はネクロソームと呼ばれ、次にMLKLのSer358 (マウスではSer345) をリン酸化します。活性化したMLKLは多量体化し、小孔複合体を形成して細胞膜に移行し、ホスファチジルイノシチドと相互作用して膜の透過化と細胞の破壊を誘導します。MLKLによって細胞膜に直接的な孔が形成されることで、Ca2+やNa+の流出が起こります。また、ミトコンドリアDNA (mtDNA)、HMGB1、 IL (Interleukin) -33、IL-1α、ATPなどが細胞外に放出されます。炎症性DAMPsが細胞外空間に現れることが、免疫細胞を損傷や感染を起こした組織へリクルートするシグナルとして機能します。
 MLKLのリン酸化による小孔形成の誘導は、ネクロプトーシス細胞のマーカーになります。上図は、20 μM Z-VADで事前に30分間処理し、その後、100 nM SM-164とMouse Tumor Necrosis Factor-α (mTNF-α) #5178 20 ng/mLで2.5時間処理したL-929細胞を、Phospho-MLKL (Ser345) (D6E3G) Rabbit mAb #37333を用いて免疫蛍光染色し、共焦点顕微鏡で観察した画像を示しています。
MLKLのリン酸化による小孔形成の誘導は、ネクロプトーシス細胞のマーカーになります。上図は、20 μM Z-VADで事前に30分間処理し、その後、100 nM SM-164とMouse Tumor Necrosis Factor-α (mTNF-α) #5178 20 ng/mLで2.5時間処理したL-929細胞を、Phospho-MLKL (Ser345) (D6E3G) Rabbit mAb #37333を用いて免疫蛍光染色し、共焦点顕微鏡で観察した画像を示しています。
また、RIPK1は高度に制御されており、NF-κBシグナル伝達や細胞の生存、アポトーシス、ネクロプトーシスを開始させるための複合体で機能することに注意してください。したがって、主要タンパク質RIPK1、RIPK3、MLKLのリン酸化状態を解析することは、ネクロトーシスを特定するための重要なステップとなります。
ネクロプトーシス経路の開始には、Toll様受容体 (TLR) などの病原体認識受容体 (Pathogen Recognition Receptors:PRR) も関与します。TLRは、アダプタータンパク質であるTRIFやZBP-1を活性化し、これらはRIPK1非依存的にRIPK3に結合して活性化します。
ネクロプトーシスのプロセスは様々な方法で阻害することができます。これは多くの場合、RIPK3およびネクロソームの活性に依存しており、Caspase-8は、RIPK1と RIPK3を切断することでネクロプトーシスを阻害します。このようにして、アポトーシス経路の活性化もネクロプトーシスを阻害します。逆に、アポトーシス複合体のCaspase-8が、FLIPタンパク質 (Caspase-8の触媒不活性なホモログ) に置き換わると、RIPK1の切断が抑制されてネクロプトーシスが促進されます。RIPK1の活性を抑制することが報告されている低分子Necrostatin-1 (Nec-1) 存在下では、ネクロプトーシスが阻害される点も重要です。
近年の研究によると、ネクロプトーシスは、がんや神経変性疾患に関与していることが示唆されています。ネクロプトーシスはがんの転移に関与しており、したがって、ネクロプトーシスの経路を阻害すればがんの悪性化を抑制できると考えられます。さらに、Necrostatin-1による治療が、アルツハイマー病とパーキンソン病における細胞生存能力を改善したことが報告されています。すなわち、ネクロプトーシスの機構やその他の細胞死経路の研究は、様々な疾患の新規治療法の開発につながることが期待されています。
その他のリソース
様々なタイプの細胞死のメカニズムや形態、主要なタンパク質についての詳細は、以下のガイドをダウンロードしてご覧ください。
細胞死のメカニズムシリーズのその他のブログ記事を読む:
アポトーシスなどのプログラム細胞死を起こした細胞を強固に検出するCST® TUNELキットの詳細はこちらをご覧ください。
参考文献
-
Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018;25(3):486-541. doi:10.1038/s41418-017-0012-4
- Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019;26(1):99-114. doi:10.1038/s41418-018-0212-61.
- Escobar ML, Echeverría OM, Vázquez-Nin GH. Necrosis as Programmed Cell Death. In: Cell Death - Autophagy, Apoptosis and Necrosis. InTech.






