ネクローシス性細胞死による細胞破壊のプロセスには、よく知られているものと、近年見つかったものがあります。古典的な考え方と異なり、ネクローシス性細胞死の性質は、必ずしも物理的で偶発的なものではありません。代わりに、細胞がストレスを受け、特定の方法で細胞死を実行できない場合、他のプログラムされた細胞破壊経路を活性化することがあります。
古典的および非古典的パイロトーシス経路に関与する主要なタンパク質を標的とする抗体は、この独特な形をとる細胞死の研究に必須のツールです。
パイロトーシス細胞死の機構および経路
パイロトーシスは、病原体関連分子パターン (PAMPs: Pathogen-Associated Molecular Patterns) またはダメージ関連分子パターン (DAMPs: Damage-Associated Molecular Patterns) の存在下で、細菌、ウイルス、真菌、原生生物の細胞内感染時に誘導されるプログラムされたネクローシス性細胞死の一種です。これは通常、単球、マクロファーおよび樹状細胞などの自然免疫系の細胞で誘導されます。
ネクローシス性細胞死のインタラクティブパスウェイ図を見る
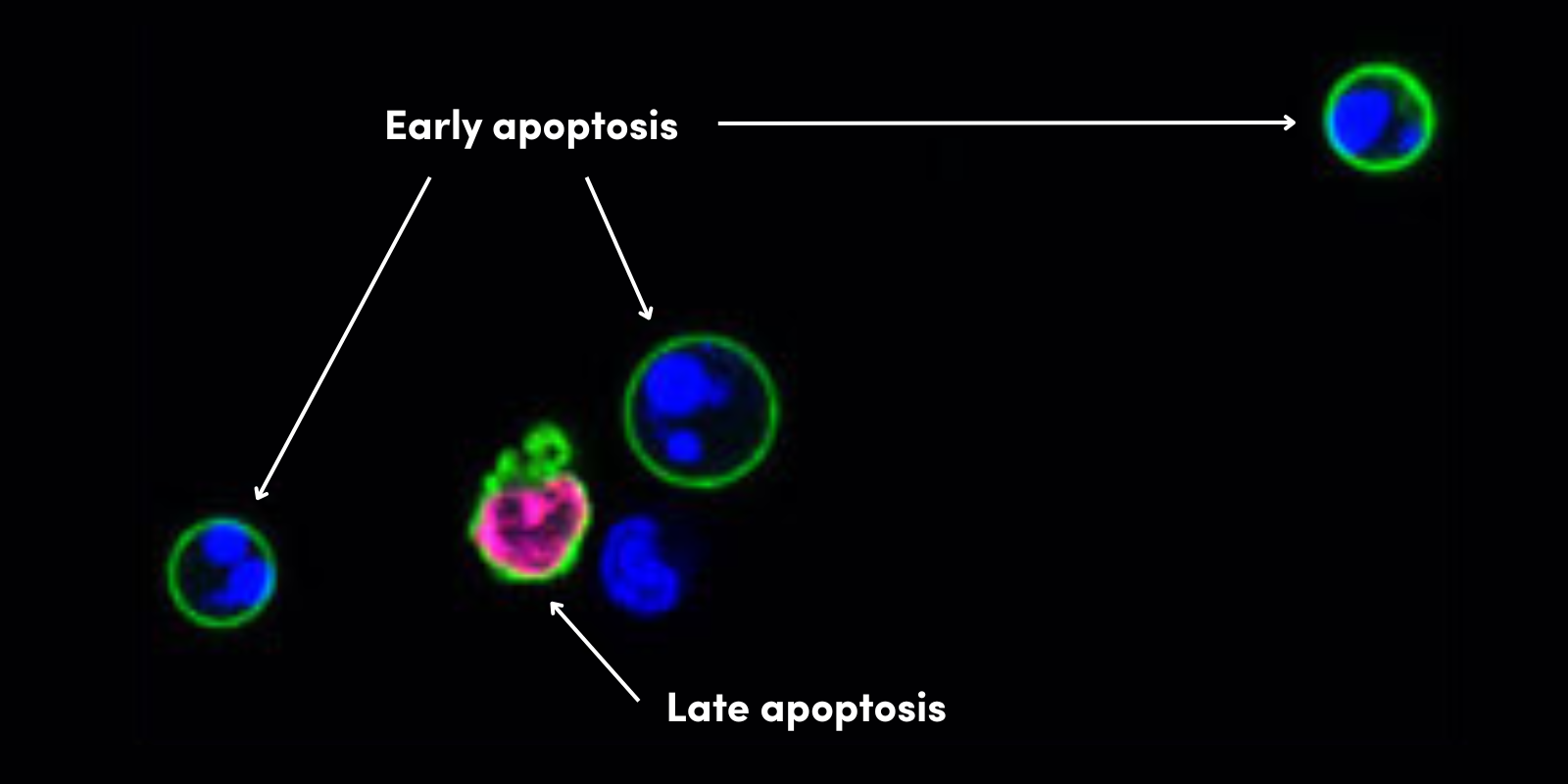
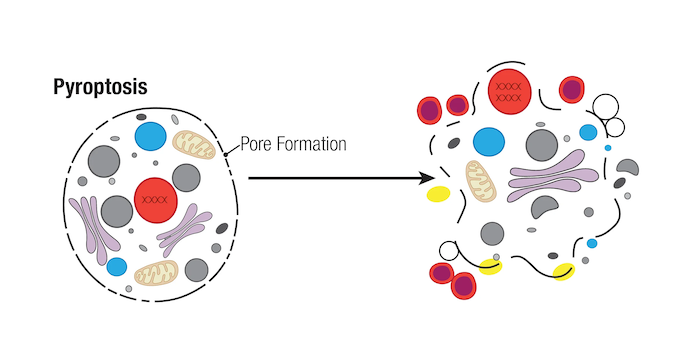
パイロトーシスは、しばしば病原への感染により引き起こされ得る細胞死の主要な様式であり、ネクロトーシスのような他のタイプの細胞死は、カスパーゼ酵素が利用できないときに、二次的なプロセスとして生じると考えられています。パイロトーシスを受ける細胞には、細胞の膨潤、膜のブレブ形成、DNAの断片化といった形態学的な特徴がみられ、最終的に細胞が溶解します。しかし、核はしばしば無傷のまま残り、これが核の崩壊が起こるアポトーシスやネクロプトーシスとは異なります。
パイロトーシスを起こした細胞ではランダムなDNAの断片化が起こりますが、核は無傷のままであるため、TUNELアッセイで解析すると弱陽性のシグナルがみられます。しかし、パイロトーシスとその他のタイプのネクローシス、アポトーシスを区別するには、別のアッセイが必要になります。
下に説明するようなマーカーに特異的な抗体を使用してパイロトーシスを特定し、その異なる経路を識別することができます。
パイロトーシス研究用抗体標的
パイロトーシスの特徴はGasdermin D (GSDMD) のN末端の切断で、この結果GSDMDが多量体化して細胞膜に溶解孔を形成します。この切断プロセスは、アポトーシスで活性化するカスパーゼとは別の、炎症性カスパーゼであるCaspase-1、caspase-4、caspase-5、caspase-11に依存します。したがって、GSDMDとその関連ファミリーメンバーの切断や、炎症性カスパーゼをモニタリングすることが、パイロトーシスを研究する上で重要なマーカーとなります。しかし、下に説明するように、異なるカスパーゼが異なるパイロトーシス経路に関与していることを認識することが重要です。
炎症性カスパーゼは、pro-interleukin-1β (pro-IL-1β) やpro-interleukin-18 (pro-IL-18) のような炎症性サイトカインのプロセシングや分泌に関与しており、自然免疫系や細菌感染に対する免疫細胞の応答に重要な役割を果たします。
パイロトーシス経路には、古典的および非古典的経路の2つの異なるものがあり、これらはさらに異なるマーカーを使用して識別できます。
古典的パイロトーシス経路
パイロトーシスの古典的経路は、しばしば、2段階のプロセスで起こると言われています。はじめのプライミングシグナルのステップでは、核内因子κB (NF-κB) が活性化され、インフラマソームと呼ばれる複合体の一部となるいくつかのタンパク質の発現が誘導されます。インフラマソームは通常、細胞質のパターン認識受容体 (PRR: Pattern Recognition Receptor、NLRP3や、AIM2様ファミリーメンバーなど)、アダプタータンパク質 (ASC/TMS1)、Pro-caspase-1から構成されています。NLRP3の検出やASCのスペックリングの可視化によって、インフラマソームの活性化を解析することが、パイロトーシスをモニタリングするためのもう一つの有用な方法です。
続く活性化のステップでは、Caspase-1がタンパク質分解で活性化された後、サイトカインであるpro-IL-1βやpro-IL-18を切断します。これによって炎症促進型のIL-1βやIL-18が産生され、死にゆく細胞から分泌されます。Caspase-1はGasdermin D (GSDMD) も切断する点も重要です。GSDMDはCaspase-1によって切断されると、N-末端フラグメントが多量体化して細胞膜に小孔を形成します。これによってサイトカインが分泌され、水が流入することで最終的には細胞が破裂します。
Caspase-1、NLRP3、ASCスペックはすべて、古典的パイロトーシス経路の必須マーカーです。
非古典的経路
これに対し、グラム陰性菌のLPSが細胞内で検出されると、Caspase-4やCaspase-5、あるいはCaspase-11 (マウスcaspase-11) が活性化され、GSDMDが切断されることにより非古典的経路でパイロトーシスが誘導されることもあります。したがって、これらのカスパーゼの活性化は、非古典的パイロトーシス経路の特定に役立ちます。
GSDMDは古典的経路と非古典的経路の両方で切断されるため、GSDMDの切断と細胞内局在の変化をモニタリングすることが、いずれかの経路を介して発生しているパイロトーシスの特定には重要です。
疾患研究におけるパイロトーシス
パイロトーシスのメカニズムの研究は、がん、自己免疫疾患、神経変性疾患などの治療に応用できる可能性があります。オメガ3脂肪酸が、トリプルネガティブ乳がん (エストロゲン受容体、プロゲステロン受容体、HERの全てが陰性で、ホルモン療法や抗HER療法の効果が期待できない乳がん) のパイロトーシスを誘導するという研究結果が得られていますが、そのメカニズムは現在はっきりしていません。炎症性大腸疾患では、インフラマソームの活性化とカスパーゼの誘導がみられ、パイロトーシスが病態に寄与することが示唆されています。このメカニズムを明らかにして新規治療法の開発につなげることが期待されています。
その他のリソース
様々なタイプの細胞死のメカニズムや形態、主要なタンパク質についての詳細は、以下のガイドをダウンロードしてご覧ください。
細胞死のメカニズムシリーズのその他のブログ記事を読む:
アポトーシスなどのプログラム細胞死を起こした細胞を強固に検出するCST® TUNELキット、パイロトーシスのAntibody Samplerキットの詳細はこちら:
参考文献
- Galluzzi L, Vitale I, Aaronson SA, et al. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. 2018;25(3):486-541. doi:10.1038/s41418-017-0012-4
- Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019;26(1):99-114. doi:10.1038/s41418-018-0212-61.
- Escobar ML, Echeverría OM, Vázquez-Nin GH. Necrosis as Programmed Cell Death. In: Cell Death - Autophagy, Apoptosis and Necrosis. InTech.