フローサイトメトリーを始めること、あるいは生細胞のみを扱っていたものに固定・透過化プロトコールも採用することは、大変ですがやり甲斐のある仕事でもあります。これによって、表面タンパク質の発現のみならず、細胞内タンパク質の発現やリン酸化の違いに関する知見を得ることができます。このような評価項目を組み合わせることで、細胞集団とそのシグナル伝達プロファイルについて、1度に独自の解析をすることができます。様々なプロトコールがある中で、CSTは世界中の研究者がダウンロードできる Antibody Staining Guide for Flow Cytometry (フローサイトメトリー用抗体染色ガイド) を開発しました。本ガイドでは抗体染色プロセスを分かり易く、段階を追って説明しています。この抗体染色ガイドに記載されているディシジョンツリーのステップと、本ブログを利用して、よくある疑問を解決していきたいと思います。
フローサイトメトリー実験で表面タンパク質をどのように染色するか?
まず、マウスの脾臓細胞を、一対の細胞表面タンパク質CD4およびTCRβで染色する場合を考えます。ここに、CD4とTCRβの、フロー検証済みマウス反応性標識抗体があります。(注意:本ブログで取り上げているTCRβを標的とするクローンH57-597は製造中止となりました)。各タンパク質が形質膜上に存在することは既知ですが、それぞれの抗体が細胞外または細胞内のどちらを認識するかを知っておく必要があります。
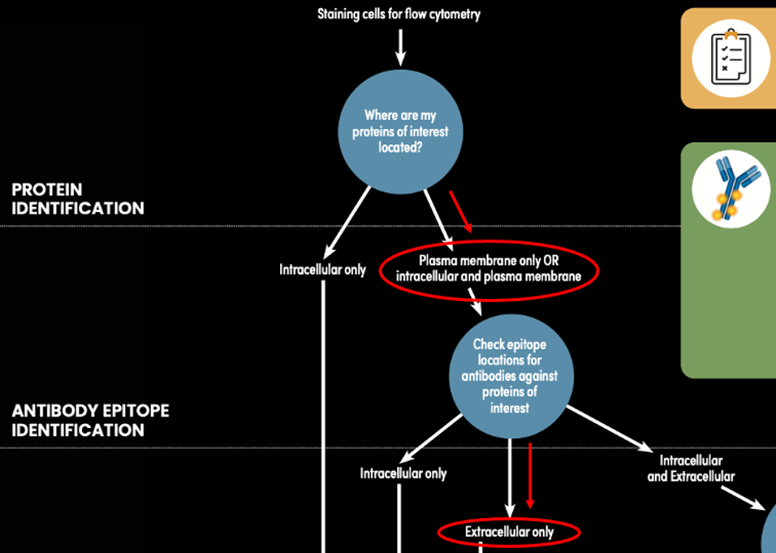 図1:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD4 (RM4-5) とTCRβ (H57-597) の例)。赤で示した線と丸に注目してください。
図1:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD4 (RM4-5) とTCRβ (H57-597) の例)。赤で示した線と丸に注目してください。
各CST抗体の製品ページには、抗原に関する基本的な情報が記載されているSource/Purificationのセクションがあります。ここにタンパク質のN末端、C末端、中央のアミノ酸というような情報が記載されている場合もありますし、単にページ内にその抗体が細胞外ドメインのエピトープと細胞内ドメインのエピトープのどちらを検出するかが記載されている場合もあります。ご不明点がある場合には、テクニカルサポートに詳細をお問い合わせください。
製品ページを参照すると、CD4を標的とするRM4-5 クローン、TCRβを標的とするH57-597クローン (製造中止) のどちらも、各標的の細胞外ドメインを検出することが記されています。このことから、これらの抗体を同時に使用して生細胞を染色できることが分かります。同じ実験で2つの抗体を用いてマルチプレックス染色する際は、コンペンセーションの必要が無いように (あるいは最小限に抑えられるように) 励起波長/蛍光波長のプロファイルが異なる蛍光色素を選択する必要があります。ここではAPCとFITCを使用することとします。ここで、CD4 (RM4-5) Rat mAb (APC Conjugate) とTCRβ (H57-597) Hamster mAb (FITC Conjugate) を用いてマウス脾臓細胞の生細胞を同時に染色すると、どのような結果が得られるかを紹介します:
 図2:生細胞プロトコールを用い、TCRβ (H57-597) Hamster mAb (FITC Conjugate) (右) またはFITC標識した等濃度のアルメニアンハムスターアイソタイプコントロール (左) で染色したC57BL/6マウスの脾臓細胞を解析しました。サンプルは同時に、CD4 (RM4-5) Mouse mAb (APC Conjugate) で共染色しました。
図2:生細胞プロトコールを用い、TCRβ (H57-597) Hamster mAb (FITC Conjugate) (右) またはFITC標識した等濃度のアルメニアンハムスターアイソタイプコントロール (左) で染色したC57BL/6マウスの脾臓細胞を解析しました。サンプルは同時に、CD4 (RM4-5) Mouse mAb (APC Conjugate) で共染色しました。
フローサイトメトリー実験で、表面タンパク質と細胞内タンパク質をどのように染色するか?
細胞表面タンパク質の発現に関するデータを収集することも勿論重要ですが、細胞内で起こっている事象に関する情報が必要になる場合もあります。一般に、表面タンパク質の発現プロファイルを知ることで、サンプル中に存在する細胞のタイプを特定することができます。一方、細胞内タンパク質や翻訳後修飾を調べることで、細胞がどのように機能しているかについての知見を得ることができます。次に、T細胞 (末梢血単核細胞 (PBMC: Peripheral blood mononuclear cell) の細胞集団から、CD3の発現を元に識別することができる) において、Tox/Tox2の発現を調べたい、というシナリオを仮定して説明を進めます。細胞内タンパク質 (Tox/Tox2) の染色を行うので、固定と透過化が必要になります。
まず、CSTの プロトコール適応表 で、固定・透過化した細胞をCD3で共染色できるかどうかを確認し、サンプルの順次染色にかかる余計な時間を省くことができる可能性があります。
UCHT1はヒトに反応性があり、細胞外エピトープを認識するCD3のクローンで、CSTが一般に推奨している全ての固定・透過化プロトコールで良好に機能します。つまり、PBMCを固定および透過化した後に、anti-CD3 (UCHT1) とanti-Tox/Tox2 (E6G5O) 抗体で同時に染色できるため、時間を節約できます。4%ホルムアルデヒドで固定し、氷冷した90%メタノールで透過化するプロトコールを使用することができます。これらの試薬はすべて、単品購入またはIntracellular Flow Cytometry Kit (Methanol) #13593として購入可能です。
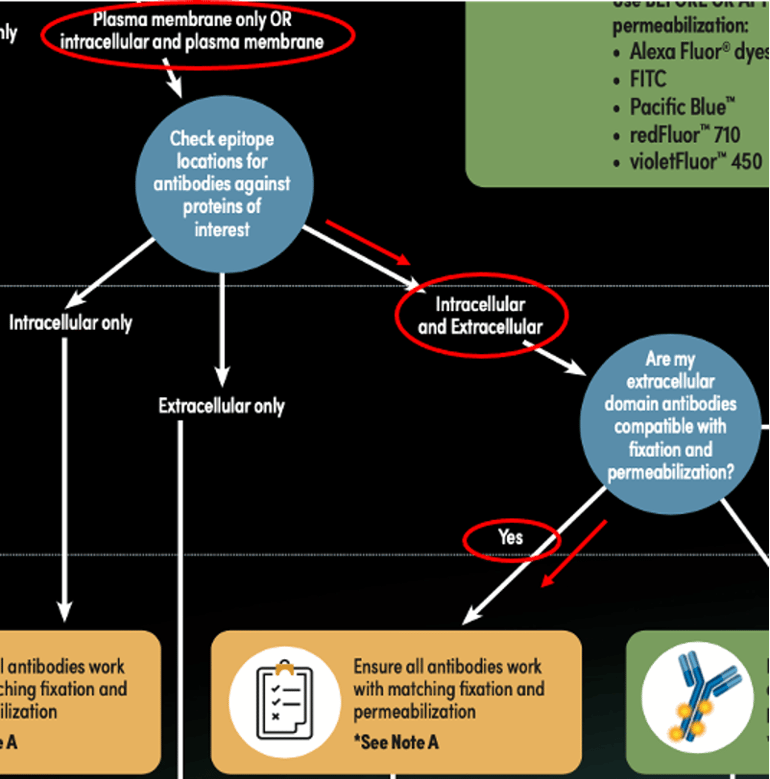 図3:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD3 (UCHT1) とTox/Tox2 (E6G5O)の例)。赤で示した線と丸に注目してください。
図3:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD3 (UCHT1) とTox/Tox2 (E6G5O)の例)。赤で示した線と丸に注目してください。
ここで、得られた結果を紹介します。4つの象限に、それぞれ異なるPBMCの集団が含まれています:
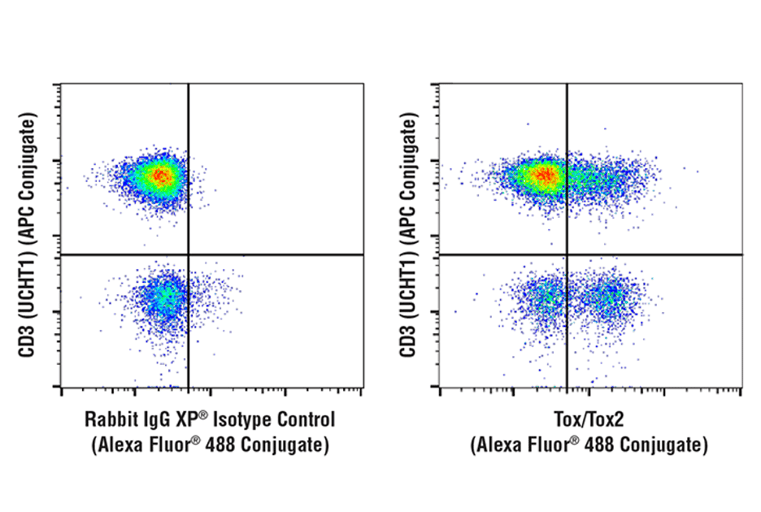 図4:固定・透過化したヒトPBMCを、Tox/Tox2 (E6G5O) Rabbit mAb (Alexa Fluor® 488 Conjugate) (右) または等濃度のRabbit (DA1E) mAb IgG XP® Isotype Control (Alexa Fluor® 488 Conjugate) (左) で染色し、リンパ球集団にゲート設定した解析結果を示しました。サンプルは同時に、CD3 (UCHT1) Mouse mAb (APC Conjugate) で共染色しました。
図4:固定・透過化したヒトPBMCを、Tox/Tox2 (E6G5O) Rabbit mAb (Alexa Fluor® 488 Conjugate) (右) または等濃度のRabbit (DA1E) mAb IgG XP® Isotype Control (Alexa Fluor® 488 Conjugate) (左) で染色し、リンパ球集団にゲート設定した解析結果を示しました。サンプルは同時に、CD3 (UCHT1) Mouse mAb (APC Conjugate) で共染色しました。
表面および細胞内タンパク質が同時に染色できない場合の染色の最適化
残念ながら、同時にすべての抗体でサンプルを染色できない場合もあります。次の例として、CD11c陽性のPBMCのうち、転写因子BATF3を発現するものを調べたい場合を説明します。先程と同様、細胞内の標的と細胞膜の標的を調べたいという状況です。
このプロトコール互換性表では、ヒト反応性CD11c (3.9) クローンが、生細胞では適切に機能するものの、FoxP3/転写因子プロトコール以外の固定および透過化した細胞では良好に機能しないことを示しています。また、BATF3 (E3K5H) クローンを選択した場合に、OTSに利用できる直接標識抗体はありません。(注意:BATF3 (E3K5H) クローンに対するOTS標識抗体は、本ブログ公開後に入手可能になりました。こちらをご覧ください:BATF3 (E3K5H) clone)。幸い、共染色するのは1種類 (CD11c) のみで、BATF3抗体 (ラビット宿主) とは免疫動物種が異なる (マウス宿主) ので、抗ラビット二次抗体を用いることでBATF3を検出することができます。
BATF3抗体の製品ページでは、ホルムアルデヒドで固定した後、メタノールで透過化することが推奨されていますので、まずCD11c抗体で生細胞 (PBMC) を染色し、その後BATF3の推奨プロトコールで染色する計画が立てられます。
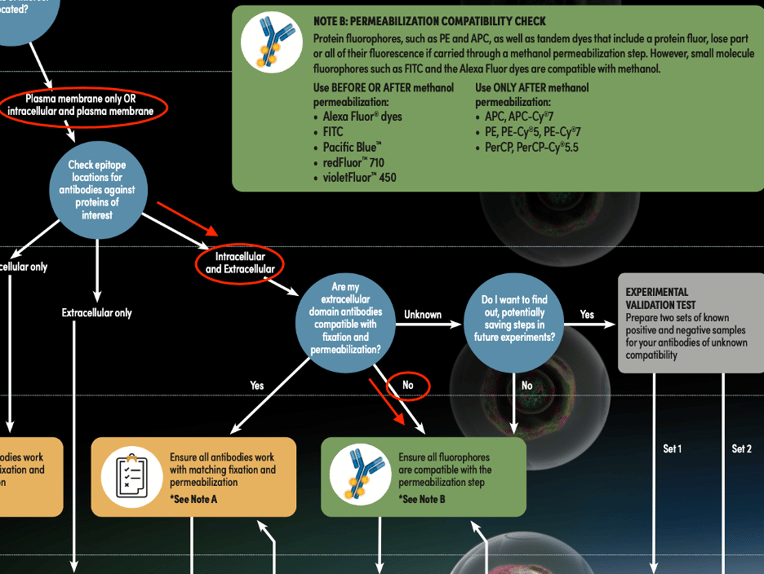 図5:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD11c (3.9) とBATF3 (E3K5H) の例)。赤で示した線と丸に注目してください。
図5:フローサイトメトリー用抗体染色ガイドを利用した適切な染色プロトコールの決定 (CD11c (3.9) とBATF3 (E3K5H) の例)。赤で示した線と丸に注目してください。
ディシジョンツリーの吹き出しを確認すると、メタノールは蛍光タンパク質を変性させる有機溶媒であることが分かります。このため、メタノールによる透過化処理を経ても蛍光が保持される低分子蛍光色素 (今回はFITC) を選択する必要があります。サンプルをCD11c FITC標識抗体で染色した後に、サンプルを固定および透過化します。その後、BATF3抗体で染色し、次いでanti-rabbit Alexa Fluor® 647 conjugated secondary antibodyで染色します。染色後データ解析をすると、次の図のように、両方の評価項目において陽性集団と陰性集団が明確に分離された結果が得られます。
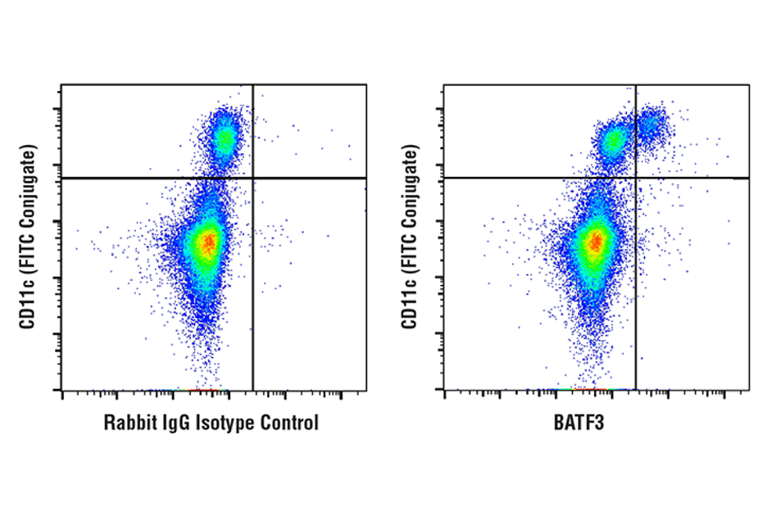 図6:固定・透過化したヒトPBMCを、BATF3 (E3K5H) Rabbit mAb (右) または等濃度のRabbit (DA1E) mAb IgG XP® Isotype Control (左) で染色した解析結果を示しました。固定前にCD11c (3.9) Mouse mAb (FITC Conjugate) で共染色しました。Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) を二次抗体として使用しました。
図6:固定・透過化したヒトPBMCを、BATF3 (E3K5H) Rabbit mAb (右) または等濃度のRabbit (DA1E) mAb IgG XP® Isotype Control (左) で染色した解析結果を示しました。固定前にCD11c (3.9) Mouse mAb (FITC Conjugate) で共染色しました。Anti-rabbit IgG (H+L), F(ab')2 Fragment (Alexa Fluor® 647 Conjugate) を二次抗体として使用しました。
本ブログ記事で紹介したシナリオでは、フローサイトメトリー用抗体染色ガイドおよびプロトコール互換表 を参照して、サンプルを2種類の抗体で染色する場合を想定していますが、これらのガイドは3種類以上の指標をマルチプレックス化する際にも活用できます。生細胞を染色するのか、固定および透過化された細胞を染色するのか、またはその両方の組み合わせなのかに関わらず、適正なコントロールを含めることや、蛍光色素分子のスペクトルの重なり合いを最小化するといった一般的なフローサイトメトリーの考慮を計算に入れるようにしてください。最終的に、より柔軟に蛍光色素を追加したい場合は、CSTのカスタム抗体標識サービスに問い合わせることも検討してください。実験の成功をお祈りします!