タンパク質の発現が非常に低い標的抗原や発現が未知の標的抗原の抗体検証には、組換えタンパク質や、代理細胞株における外来性のタンパク質発現が必要な場合があります。In vivoの状態をより正確に示す内因性の実験系が好まれていますが、不均一戦略にはいくつかの利点があります。
抗体の交差反応性の試験
不均一戦略は、タンパク質のアイソフォームや、保存性の高いファミリーメンバーと抗体の交差反応を検証するために利用することができ、抗原の相同性に基づく抗体のオフターゲット結合の可能性に関して有用な情報を得ることができます。 また、不均一戦略を用い、発現量の調整や組換えタンパク質の希釈による標的タンパク質のタイトレーションによって、抗体の感度試験を行うこともできます。
不均一戦略の他の使用方法としては、免疫沈降 (IP) で機能する抗体の能力の検証や、ウェスタンブロット (WB) アプリケーションの標準的なポジティブコントロールの生成などが挙げられます。さらに、不均一戦略は微妙に異なる様々な形態のタンパク質を発現させることにより、部位特異的変異に対する抗体の特異性を検証することができます。
組換えタンパク質を用いた抗体の特性の検証
組換えタンパク質の一般的な使用方法は、タンパク質ファミリーのうち1つ以上に対する抗体の特異性の検証です。PKCδ (D10E2) Rabbit mAbの特異性を確認するため行った、9つの異なる組換えタンパク質キナーゼC (PKC) アイソフォームのWB解析を示した図1が、この良い例です。この場合、抗体の結合はアイソフォーム特異的であり、他の試験している組換えアイソフォームに対する標的外結合は観察されません。
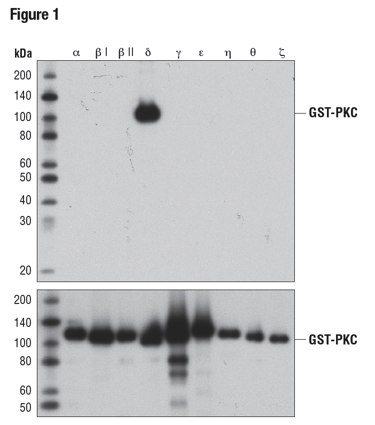
図1:PKCδ (D10E2) (上) またはGST (91G1) (下) を用いて、GSTタグ付けされたPKCアイソフォームをWBで解析しました。組換えタンパク質はバクテリアで発現させました。この結果から、PKCδへの特異性が確認できました。
図2は少し異なるアプローチで、14-3-3 (pan) 抗体の汎用性を示しています。WBのデータは、試験に用いた6つの組換えアイソフォームすべてを抗体が認識したことを示しており、アイソフォームの汎用性を示すエビデンスとなっています。重要なことに、ローディングコントロールを含めたことにより、バンドの強度における違いがタンパク質のロードによるものであり、異なるアイソフォームに対する抗体の親和性の違いによるものではないことが分かります。
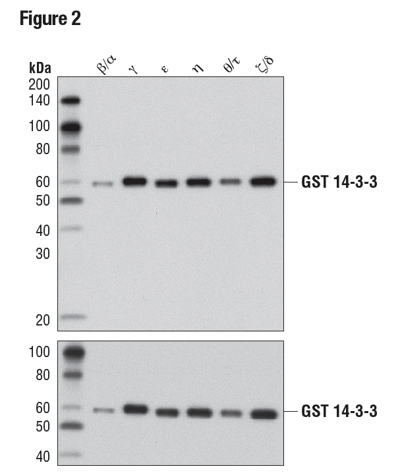 図2:精製された組換えGSTタグ付加14-3-3アイソフォームを、14-3-3 (pan) (上) あるいはGST (91G1) (下) を用いてWBで解析しました。この結果から、アイソフォームの交差反応性が確認できました。
図2:精製された組換えGSTタグ付加14-3-3アイソフォームを、14-3-3 (pan) (上) あるいはGST (91G1) (下) を用いてWBで解析しました。この結果から、アイソフォームの交差反応性が確認できました。
ここでの重要なポイントは、組換えタンパク質またはペプチドアレイは抗体の特異性と交差反応性を判断するために使用できるものの、これらのアッセイは人工的な性質を持つため、この2つの種類の方法から得られる結果は誤解を招くことがあります。さらに現在、これらの系のいくつかの主要な機能は標準化されておらず、このブログシリーズで概説されている他の検証戦略によって不均一戦略を裏付けることが重要です。
抗体の特異性と交差反応性を検証するための不均一な発現
一般に不均一実験系では、目的の標的抗原を発現するように設計されたDNAプラスミドを、組換えタンパク質の代わりに用います。この戦略は、抗体の特異性を検証し、アイソフォーム、ホモログ、オーソログとの交差反応性を決定するのに一般的に使用されます。この方法で発現したタンパク質は、ウェスタンブロットまたは免疫蛍光細胞染色など確立された技術で簡便に解析できます。
不均一発現は、エピトープタグに対する抗体、哺乳類細胞にて内在的に発現されないタンパク質、あるいは限られた条件や稀な細胞集団でのみ発現するタンパク質を検証するために必要なステップです。これらの標的は内在性の系では解析できないため、抗体の特異性を検証するには不均一発現が不可欠です。
図3では、Myc/DDKタグを付加した様々なMAGEアイソフォームを発現するコンストラクトをトランスフェクションした293T細胞から調製したライセートを、MAGE-A3抗体を用いてWBで解析しています。MAGE-A3は、多様な腫瘍細胞に発現することの多い核タンパク質で、293Tにより内在的に発現されることはありません。このデータは、トランスフェクションの成功を確認するDYKDDDK抗体とローディングコントロールとして用いるβ-Actin抗体の結果と、MAGE-A3に対する抗体の特異性を示しています。
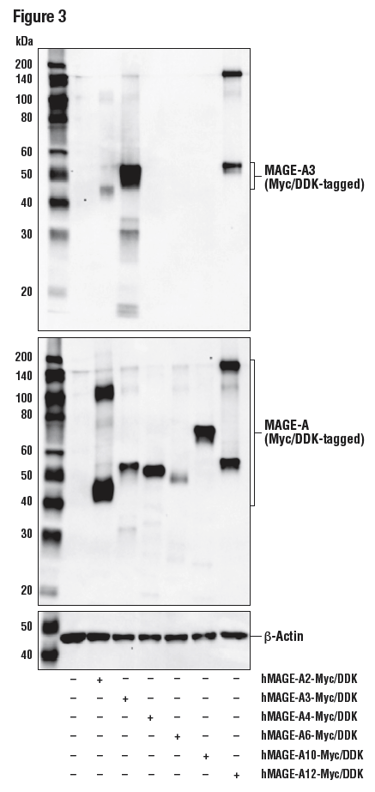
図3:Mockトランスフェクション (-)、全長ヒトMAGE-A2 (hMAGEA2-Myc/DDK)、Myc/DDKでタグ付けされた全長ヒトMAGE-A3 (hMAGE-A3-Myc/DDK)、Myc/DDKでタグ付けされた全長ヒトMAGE-A4 (hMAGE-A4-Myc/DDK)、Myc/DDKでタグ付けされた全長ヒトMAGE-A6 (hMAGE-A6-Myc/DDK)、Myc/DDKでタグ付けされた全長ヒトMAGE-A10 (hMAGE-A10-Myc/DDK)、およびMyc/DDKでタグ付けされた全長ヒトMAGE-A12 (hMAGE-A12-Myc/DDK) を発現するコントラクトをトランスフェクションした (+) 293T細胞の抽出物を、MAGE-A3 (E9S4X) (上)、DYKDDDK Tag抗体 (中)、およびβ-Actin (D6A8) (下) を用いてWBで解析しました。
図4は、実際に実験で用いることを想定したモデルにおいて、人為的に発現させたタンパク質Cas9に対する抗体検証のデータを示しています。ここでは、mycでタグ付けされたCas9を293T細胞にトランスフェクションし、Cas9 (S. pyogenes) (E7M1H) rabbit mAbを用いて免疫組織化学染色して解析しました。cDNAの発現を確認するため、Myc-Tag (9B11) Mouse mAbを使用しました。
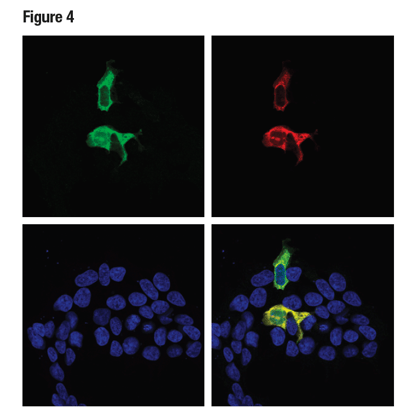 図4:Cas9 (S. pyogenes) (E7M1H) (緑) およびMyc-Tag (9B11) (赤) を用いてmycでタグ付けされたCas9 (S. pyogenes) コンストラクトを一過的にトランスフェクションした293T細胞をICC染色し、共焦点顕微鏡で解析しました。緑色と赤色のシグナルの共局在化が、合成画像では黄色に見えます (右下)。サンプルはProLong® Gold Antifade Reagent with DAPI (青) を用いてマウントしました。
図4:Cas9 (S. pyogenes) (E7M1H) (緑) およびMyc-Tag (9B11) (赤) を用いてmycでタグ付けされたCas9 (S. pyogenes) コンストラクトを一過的にトランスフェクションした293T細胞をICC染色し、共焦点顕微鏡で解析しました。緑色と赤色のシグナルの共局在化が、合成画像では黄色に見えます (右下)。サンプルはProLong® Gold Antifade Reagent with DAPI (青) を用いてマウントしました。
部位特異的変異体の検出
不均一戦略では、野生型タンパク質の発現に限らず、ほぼ無数のコンストラクトの発現を用いることができます。部位特異的抗体の特異性は、バクテリアまたは哺乳類細胞に外因的に・組換え的に発現されたタンパク質の部位特異的な変異体を使って確認できます。
この概念を説明するため、図5にThr359がリン酸化されたp90RSKタンパク質に対するphospho-p90RSK (Thr359) (D1E9) rabbit mAbの特異性を示しました。ここでは、Thr359からAla (T359A) への変異体、Ser362 からAla (S362A) への変異体、または二重変異体 (T359A/S362A)、またp90RSKファミリーメンバーであるRSK2およびRSK3の野生型タンパク質を発現する細胞から調製されたライセートの調査に、本抗体を使用しました。
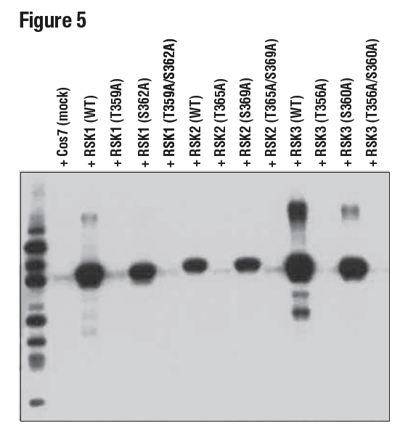 図5:Mockトランスフェクションまたは野生型 (WT) RSK1、RSK2、およびRSK3、または示唆された部位特異的変異を発現するコンストラクトをトランスフェクトした293T細胞からの抽出物を、Phospho-p90RSK (Thr359) (D1E9) を用いてWBで解析しました。RSK1 (Thr359)、RSK2 (Thr365)、およびRSK3 (Thr356) の抗体のリン酸化特異的反応性を示しています。
図5:Mockトランスフェクションまたは野生型 (WT) RSK1、RSK2、およびRSK3、または示唆された部位特異的変異を発現するコンストラクトをトランスフェクトした293T細胞からの抽出物を、Phospho-p90RSK (Thr359) (D1E9) を用いてWBで解析しました。RSK1 (Thr359)、RSK2 (Thr365)、およびRSK3 (Thr356) の抗体のリン酸化特異的反応性を示しています。
これらの結果は、トレオニン部位に対する特異性と、他のファミリーメンバー上の保存された部位を同等に検出する能力という、抗体の2つの重要な特徴を強調しています。これらの検証実験は、他社の大半においてほとんど行われていない、または軽視されています。
不均一戦略は、抗原標的の人為的な発現に依存するという点で他の検証戦略とは大きく異なるため、他の検証戦略と組み合わせることによって抗体の特異性と感度に関する有意義な知見を得ることが最も重要です。不均一戦略は、単独で使用すると誤解を招くことがありますが、他の検証方法と組み合わせて使うと、非常に強力な抗体検証法となります。
追加の抗体検証リソース
CSTの抗体の検証における戦略に関するその他のブログを読む: