CUT&RUNは、クロマチン免疫沈降 (ChIP) またはChIPシーケンシング (ChIP-seq) を活用し、わずか1-2日で5,000個-20,000個という非常に少ない細胞からDNAを抽出することができます。他の抗体ベースの手法と同様に、アッセイの成功には適合する抗体の特定が必要不可欠です。CUT&RUNは、比較的新しい手法であるため使用可能な検証済み抗体の数が限られています。そのため、ChIPまたはChIP-seq検証済み抗体をCUT&RUNに用いることを推奨している企業もあります。これらの3つの手法には、細胞や組織のゲノム全体のタンパク質-DNA間の相互作用の解析に用いられるという共通点があるためです。
しかし、ChIP検証済み抗体のすべてが、CUT&RUNアッセイで本当に機能するのでしょうか?実際のところ、すべてが機能するわけではないことを弊社は確認済みです。その理由をご紹介しましょう。
ChIPまたはChIP-seqで検証された抗体が、CUT&RUNで機能するか?
ChIPとCUT&RUNアッセイは、どちらもクロマチンのプロファイリングに用いられますが、各アッセイが採用している方法には抗体の認識に影響を及ぼすほどの大きな違いがあります。これらの違いを、表1に示します。
ChIP |
CUT&RUN |
|
|
サンプルの調製 |
ホルムアルデヒドでクロマチンをクロスリンクし、細胞を溶解 |
細胞を、コンカナバリンAでコートした磁気ビーズと結合させた後、細胞膜をジギトニンで透過化 |
|
クロマチンの濃縮 |
DNA結合タンパク質またはヒストン修飾に特異的な抗体を用いてIn vitroで免疫沈降 |
細胞膜の透過化後、DNA結合タンパク質やコファクター、ヒストン修飾に特異的な抗体を核へ侵入させてIn vivoで濃縮 |
|
クロマチンの断片化 |
クロマチン免疫沈降の前に、MNaseを用いて標的を定めずにクロマチンを酵素消化、またはソニケーションで機械的に切断 |
一次抗体とpAG-MNaseが相互作用し、濃縮の間に標的部位を酵素消化 |
|
クロマチン/タンパク質の状態 |
部分的に変性したヒストンやDNA結合タンパク質を含む、断片化したクロマチン |
未変性のヒストンやDNA結合タンパク質と、連続的なクロマチン |
表1:ChIPとCUT&RUNが採用する方法の違い
ChIPまたはChIP-seq検証済み抗体のすべてがCUT&RUNで機能するわけではない
弊社が、100種類以上の標的タンパク質 (現在も拡大中!) に対する抗体を試験したところ、ChIPまたはChIP-seq用抗体のうちCUT&RUNに適合するのは、わずか50-60%であることが判明しました。ChIP実験はSimpleChIP Plus Enzymatic Chromatin IP Kit (Magnetic Beads) #9005を、CUT&RUN実験はCUT&RUN Assay Kit #86652およびDNA Purification Buffers and Spin Columns (ChIP, CUT&RUN) #14209を用いて行いました。また、後続の定量PCR (qPCR) 解析はSimpleChIP Universal qPCR Master Mix #88989を、DNAライブラリー調製はDNA Library Prep Kit for Illumina (ChIP-seq, CUT&RUN) #56795およびMultiplex Oligos for Illumina (Dual Index Primers) #47538を用いて行いました。NG-seqは、Illumina NextSeq Platformを用いて行いました。
ChIP検証済みのStat1 (D1K9Y) Rabbit mAb #14994と、ChIPおよびChIP-seq検証済みのStat1 (D4Y6Z) Rabbit mAb #14995を試験したところ、どちらの抗体もChIPで標的遺伝子を確かに濃縮することができました (図1A)。Stat1 #14994は、ChIP-seqでは読み取り可能なデータが得られませんでしたが、CUT&RUNアッセイでは濃縮することができました。一方、ChIPおよびChIP-seq検証済みのStat1 #14995は、STAT1の既知の標的遺伝子であるIRF1とAIM2のどちらの濃縮もみられなかったため、CUT&RUNでは機能していないと考えられます (図1B)。
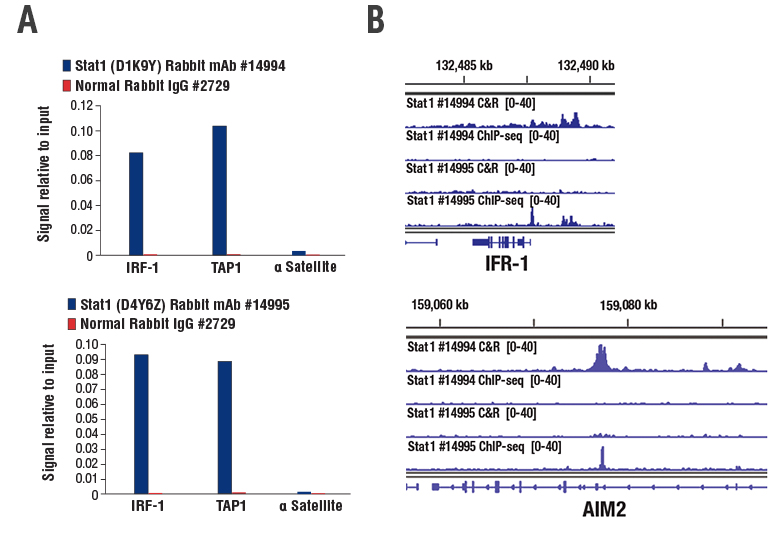 図1:hIFN-γ (Human Interferon-γ) 処理したHT-1080細胞を用いて、ChIPおよびCUT&RUN実験を行いました。STAT1に対するどちらのラビットモノクローナル抗体も、ChIPで標的遺伝子の確かな濃縮がみられましたが (A)、CUT&RUNで標的遺伝子の濃縮がみられたのはStat1 (D1K9Y) Rabbit mAb #14994のみでした (B)。ChIP-seq検証済みStat1 (D4Y6Z) Rabbit mAb #14995は、ChIP-seqで標的遺伝子を濃縮することができましたが、CUT&RUNでは機能しませんでした (B) 。
図1:hIFN-γ (Human Interferon-γ) 処理したHT-1080細胞を用いて、ChIPおよびCUT&RUN実験を行いました。STAT1に対するどちらのラビットモノクローナル抗体も、ChIPで標的遺伝子の確かな濃縮がみられましたが (A)、CUT&RUNで標的遺伝子の濃縮がみられたのはStat1 (D1K9Y) Rabbit mAb #14994のみでした (B)。ChIP-seq検証済みStat1 (D4Y6Z) Rabbit mAb #14995は、ChIP-seqで標的遺伝子を濃縮することができましたが、CUT&RUNでは機能しませんでした (B) 。
また、3種類のStat3抗体についても試験しました。Stat3 (124H6) Mouse mAb #9139とStat3 (79D7) Rabbit mAb #4904 (いずれもChIPおよびChIP-seq検証済み)、およびStat3 (D3Z2G) Rabbit mAb #12640を用いました。先ほどと同様に、3種類のすべての抗体でChIP実験における標的遺伝子の確かな濃縮がみられましたが (図2A)、CUT&RUNで標的遺伝子の確かな濃縮がみられたのは、Stat3 #9139のみでした (図2B)。Stat3 #12640は、CUT&RUN実験において標的遺伝子の濃縮がある程度みられましたが、ゲノムのシグナル対ノイズ比が低く、Cell Signaling Technology (CST) の検証基準を満たしませんでした。
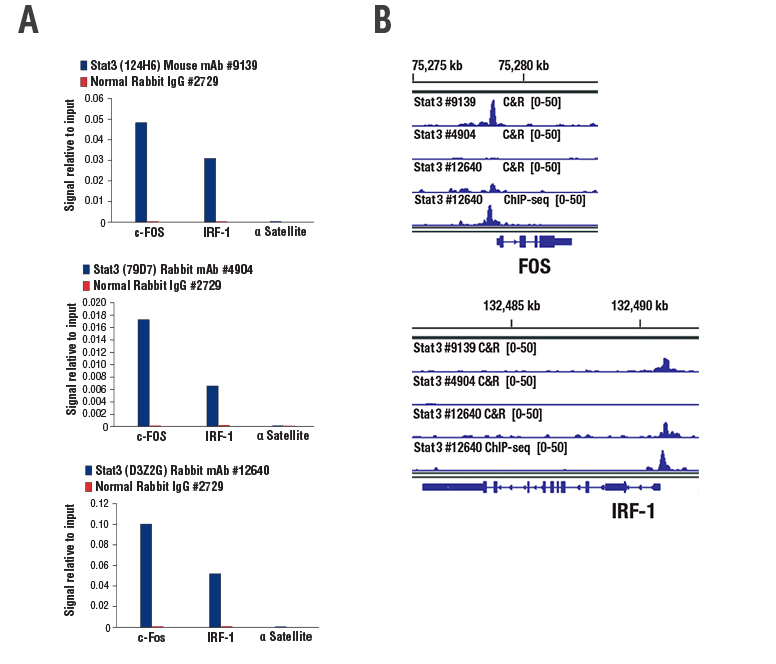 図2:一晩の飢餓状態とIL-60処理を行ったHepG2細胞を用いてChIPおよびCUT&RUN実験を行いました。STAT3に対する3種類のモノクローナル抗体すべてで、ChIPにおける標的遺伝子の確かな濃縮がみられましたが (A)、CUT&RUNでは標的遺伝子の確かな濃縮がみられたのはStat3 (124H6) Mouse mAb #9139だけでした (B)。ChIP-seq検証済みのStat3 (D3Z2G) Rabbit mAb #12640は、CUT&RUNにおいて標的遺伝子の濃縮がみられましたが (B)、バックグラウンドシグナルが高いため検証基準を満たしませんでした。
図2:一晩の飢餓状態とIL-60処理を行ったHepG2細胞を用いてChIPおよびCUT&RUN実験を行いました。STAT3に対する3種類のモノクローナル抗体すべてで、ChIPにおける標的遺伝子の確かな濃縮がみられましたが (A)、CUT&RUNでは標的遺伝子の確かな濃縮がみられたのはStat3 (124H6) Mouse mAb #9139だけでした (B)。ChIP-seq検証済みのStat3 (D3Z2G) Rabbit mAb #12640は、CUT&RUNにおいて標的遺伝子の濃縮がみられましたが (B)、バックグラウンドシグナルが高いため検証基準を満たしませんでした。
抗体 |
ChIP検証済み |
ChIP-seq検証済み |
CUT&RUNでの機能 |
|
Stat1 (D1K9Y) Rabbit mAb #14994 |
Yes |
No |
Yes |
|
Stat1 (D4Y6Z) Rabbit mAb #14995 |
Yes |
Yes |
No |
|
Stat3 (124H6) Mouse mAb #9139 |
Yes |
No |
Yes |
|
Stat3 (79D7) Rabbit mAb #4904 |
Yes |
No |
No |
|
Stat3 (D3Z2G) Rabbit mAb #12640 |
Yes |
Yes |
No |
表2:CUT&RUNで試験された上述の抗体のまとめ
上述の2つの例が示すように、抗体がChIPまたはChIP-seq検証済みであっても、必ずしもCUT&RUNの成功が保証されるとは限りません。そのため、CSTのCUT&RUN検証済み抗体をご利用いただくことが、最も確実な方法となります。しかし、CUT&RUN検証済み抗体がまだ特定されていない場合、ChIPまたはChIP-Seq検証済み抗体を試しても良いかもしれません。ただし、機能する抗体をみつけるため、複数の抗体を比較検討する必要があることにご注意ください。
CSTは、お客様ご自身で抗体の試験を行う時間とコストを削減するため、精力的にCUT&RUN抗体の検証を行っています。
CSTのCUT&RUN用抗体の検証方法
CSTは、各アプリケーションで抗体が機能することを保証するため、厳格な検証基準を採用していることが知られていますが、CUT&RUN用抗体の検証についても同様です。弊社は、CUT&RUNで機能することが実証されている抗体を提供するため、CUT&RUN Assay Kit #86652やDNA Purification Buffers and Spin Columns (ChIP, CUT&RUN) #14209、SimpleChIP Universal qPCR Master Mix #8898、DNA Library Prep Kit for Illumina #56795 (ChIP-seq, CUT&RUN)、Multiplex Oligos for Illumna (Dual Index Primers) #47538を用いて弊社のすべての抗体を試験しています。
CUT&RUN検証済み抗体として合格するには、以下の合格基準のすべてを満たす必要があります。
- 抗体の感度:標的の濃縮シグナル対ノイズ比を、Inputコントロールと比較します。合格するには、明確な濃縮ピークが許容可能な最小数であり、かつInputクロマチンと比較してシグナル対ノイズ比が最小である必要があります。
- 抗体の特異性:
•ノックアウト細胞株と野生型細胞株のシグナルを比較します。ノックアウト細胞が手に入らない場合は、標的タンパク質の異なるエピトープに対する複数の抗体を用いて、ゲノム全体にわたる濃縮ピークのプロファイルに矛盾がないかを確認します。
•多タンパク質複合体の異なるサブユニットの抗体を用いて、濃縮ピークのプロファイルに矛盾がないかを確認します。
•標的タンパク質に対する別の抗体を用いて、一般公開されているCUT&RUNおよびChIP-seqのデータ (すなわちENCODE) とゲノム全体にわたる濃縮データを比較します。
•定量PCR (qPCR) を用いて、既知のポジティブ標的遺伝子座およびネガティブ標的遺伝子座の濃縮を解析します。既知のポジティブ標的遺伝子座の検出に必要な増幅回数は、既知のネガティブ標的遺伝子座と比較して最小でなくてはいけません。また、標的特異的抗体とアイソタイプコントロール抗体を比較し、既知の標的遺伝子座の濃縮の程度によって決定されるシグナル対ノイズ比が最小である必要があります。 - 配列特異的DNA結合転写因子に対する抗体の特異性:濃縮したクロマチン断片の転写因子結合モチーフ解析を行います。
ChIPまたはChIP-seq検証済み抗体のうち、CUT&RUNに適合している抗体はわずか50-60%であるため、必ずしもCUT&RUNが成功するとは限りません。ご自身で抗体のスクリーニングを行う前に、拡大中のCSTによる検証済みCUT&RUN用抗体の一覧をご確認ください。貴重な時間の節約になるかもしれません。
追加リソース:
- 標的の検証済み抗体が見つかりませんか?抗体の試験中の可能性がありますので、テクニカルサポートまでお問い合わせください。
- さらに詳しい情報が必要ですか?検証済み抗体の一覧やプロトコール、ビデオ、トラブルシューティングガイド、よくある質問などをまとめたCUT&RUNリソースセンターをご覧ください。以下のビデオも視聴できます。