細胞がリガンドや栄養素などの外部のシグナルを認識し、急速に変化する環境に適切に応答する能力には、主要な細胞シグナル伝達ネットワークの間のクロストークが関与しています1,2。これらの複雑なパスウェイは細胞内栄養素、代謝フラックス、ストレスを感知し、多数の下流エフェクターを介してこれらの異なるシグナルを統合します1,2。重なり合い交差するパスウェイの複雑な性質を理解しようとすることは、科学者にとって興味深いパズルのように思えます。
多くのシグナル伝達経路の中で、私が最も情熱を注いでいるのはPI3K/Aktシグナル伝達経路です。私の名前はSrikanth Subramanian、Cell Signaling Technologyのシニアプロダクトサイエンティストであり、すべてのPI3K/Akt抗体とその下流パスウェイのいくつかの標的の抗体を調製し管理するチームの一員です。そのため、興味を持つ分野に多少の偏りがあるかもしれません。
私のPI3K/Aktシグナル伝達との関係は、CSTに勤務するより前、大学院生だった時から始まり現在に至ります。長年にわたり、シグナル伝達経路の標的の研究に取り組むことで、個人レベルでは永続的な友情を、プロフェショナルのレベルでは協力関係を築いて、多くの素晴らしい思い出を生み出し、キャリアを得ることができました。そして、私の家族を不意に襲った病気の一部がこのダイナミックなパスウェイの特定のタンパク質に関連していると知ったことによって、PI3/Aktシグナル伝達は私にとって重要な意味を持つものになりました。これらのタンパク質のいくつかと、私の家族との個人的なつながりについて詳しくお話します。
PI3K/Aktシグナル伝達経路
PI3K/Aktパスウェイは細胞外のシグナルに応答して代謝、増殖、細胞の生存、成長、血管新生を促進します1-2。これは、多様な下流の標的を通じセリンおよびスレオニンのリン酸化を介して起こります2。
PI3K/Aktシグナル伝達

PI3K / Aktシグナル伝達経路のインタラクティブパスウェイ図に含まれるCST ®抗体製品をご覧ください。
このパスウェイは生物学および医学の多様な分野で数え切れないほどの研究の焦点となっています1。AKTを制御する上流因子 (PI3K)、およびGSK3、FoxO、mTORC1などシグナル伝達系の下流で主要な役割を果たす多目的な標的に関する理解は大きく進歩しました。AKTは、ほぼすべての細胞および臓器に普遍的に存在し、機能することが分かっています1。がん、インスリン抵抗性、2型糖尿病、自己免疫障害、神経障害など、様々な疾患にAKTシグナル伝達が関与していることを考えると、AKTの調節とその機能について理解することは非常に重要です1-3。
インスリン受容体 (InsR)
2型糖尿病 (叔母と祖母)
インスリン受容体 (InsR) はヘテロ二量体膜受容体チロシンキナーゼです。ジスルフィド結合によって結合された2つの細胞外α-サブユニット (リガンド結合ドメインを含有する)、2つのβ-サブユニット (細胞外ドメイン、膜貫通型ドメイン、細胞質チロシンキナーゼドメインを含有する) から構成されています4-8。長いアイソフォーム (InsR-β) と短いアイソフォーム (InsR-α) の生理的な役割についてはまだ未知な部分もありますが、インスリン様成長因子 (IGF)、特にIGF-IIに対して異なる結合親和性を持つことが重要なようです5-7。InsR-αは主に出生前に発現し、胚形成および胎児の発生においてIGF-IIの効果を増強します6。注目すべきことに、InsR-αは成人の組織、特に脳でも発現しています。InsR-αは、IGF-IIおよびインスリンに対する感受性を高めます5-7。一方、InsR-βは主に肝臓、筋肉、脂肪組織、腎臓を含む、高度に分化した成人組織で発現し、インスリンの代謝効果を高めます5-6。
インスリン受容体シグナル伝達経路

インスリン受容体シグナル伝達経路のインタラクティブパスウェイ図に含まれるCST ®抗体製品をご覧ください。
インスリンは、人体のエネルギーホメオスタシスにおいて主要な役割を担います8。インスリンの調節機能の障害は、エネルギーバランスを乱し、2型糖尿病などの疾患を引き起こします8,9。標的細胞の制御は、細胞表面上のインスリン受容体 (IR) の活性化により開始し、グルコース摂取 (グルコース輸送体GLUT4を介して) や、細胞内シグナル伝達ネットワークを通じてのPI3KおよびAktなどのタンパク質の合成など、異なる細胞プロセスに影響を与えます8-9。2型糖尿病では、GLUT4の発現や上皮細胞の形質膜への輸送が起こらなくなることで、エネルギー産生のためにグルコースを細胞内へ取り込むことが妨げられます。9
Phosphoinositide 3-kinase (PI3K)
乳がん (2人の叔母)
PI3K/AKT経路は、乳がんで最もよく強化されるがん遺伝子経路です3,10。正常な乳腺の発生は様々なホルモンとシグナル伝達経路によって調節されています3,10。正常な乳腺の発生は様々なホルモンとシグナル伝達経路によって調節されています。これにはエストロゲン受容体 (ER) シグナル伝達、HER2 (Human epidermal growth factor receptor 2) シグナル伝達と古典的Wntシグナル伝達、サイクリン依存性キナーゼ (CDK) 、Notch、Sonic Hedgehog (SHH)、PI3K/Akt/mTORなどがあります3,10-11。PI3Kは、触媒ドメインp110と調節ドメインp85の2つのドメインで構成されています3,10。PI3K活性化のメカニズムでは、p110αをコードするPIK3CA遺伝子の変異が最も頻繁に観察され、同時にPI3Kの基質に作用してその活性を抑制するホスファターゼであるPTEN (Phosphatase and TENsin homolog) タンパク質の減少が観察されます3。PIK3CAの変異に加えて、HER2遺伝子の増幅、PTENの機能不全、AKT1 (哺乳類のゲノムで保存される3つのAKT/PKBアイソフォームのうちの1つ) を活性化突然変異など、PI3Kの活性を高める多くの分子変化があります3,10-11。
非ホジキンリンパ腫 (親友)
PI3Kファミリーは3つの異なるクラス (I、II、III) に分類されます。クラスIは、細胞の成長と生存に最も関連があり、α、β、δ、γの4つのアイソフォームが存在します12,13。 PI3Kδ、そしてγの発現は主に白血球に限定され、PI3KαとPI3Kβは普遍的に発現しています13。PI3Kαは、インスリンシグナル伝達に関わる主要なアイソフォームであり、様々なリンパ腫でも同定されていることから、リンパ腫形成における役割が示唆されています13-16。PI3Kβアイソフォームはインテグリンの形成と安定性の調節に役立ち、血小板の活性化に必要です6-8。PI3KδとPI3Kγは、白血球の輸送と細胞増殖を調節します13-16。
B細胞性非ホジキンリンパ腫 (Non-Hodgkin lymphoma:NHL) では、リン酸化AKTおよび下流のNF-kβとPI3Kパスウェイの標的を抑制するためには、PI3KαとPI3Kδを阻害する必要があります13-16。
間質性肺疾患と肺線維症 (母と叔父)
肺の損傷は様々な機構を介して発生する可能性がありますが、すべてに共通するのは、制御不能な進行性の線維症を発症するということです17。I型コラーゲンは主にヒトの肺線維性組織で見られます17。正常な生理学的な条件において、肺線維芽細胞がI型コラーゲン細胞外マトリクス (ECM) と相互作用すると、PTENによってPI3K/Aktの活性化が阻害され、線維芽細胞の増殖阻害とアポトーシス刺激につながります17。特発性肺線維症 (IPF) 線維芽細胞では、PTENが抑制されることによってPI3K/AKT活性が上昇し、コラーゲンマトリクス上でも高い増殖性およびアポトーシス抵抗性を持つようになります17。
Glycogen synthase kinase-3 (GSK-3)
神経変性疾患 (妻の祖母)
GSK-3 (Glycogen sybthase kinase-3) は、増殖、分化、細胞の接着など複数の細胞プロセスを調節する細胞性セリン/スレオニンプロテインキナーゼです18-19。GSK-3の2つのアイソフォームとしてGSK-3αとGSK-3βが同定されており、これらは脳全体で普遍的に発現しています。GSK-3はAktの活性化を通じて調節されます。GSK-3の活性は特定の部位のリン酸化に依存しており、GSK-3βのSer9あるいはGSK-3αのSer21のリン酸化は活性を阻害し、GSK-3βのTyr216およびGSK-3αのTyr279のリン酸化は活性を上昇させます18-19。
GSK-3の調節不全はアルツハイマー病 (Alzheimer's disease:AD) およびパーキンソン病 (Parkinson's disease:PD) を含む疾患の病因に関係しています18-19。GSK-3は、長年神経変性疾患との関与が研究されているTau、β-amyloid (Aβ)、α-Synucleinと相互作用します。Aβの産生はGSK-3によって調節され、その毒性はGSKによって誘導されるTauのリン酸化と変性によって媒介されます19。α-SynucleinはGSK-3の基質です。GSK-3の阻害は、パーキンソン病に関連する有害物質に対して保護的に働きます18-19。
FoxO1とFoxO3a
自己免疫疾患と全身性エリテマトーデス (母)
FoxO (Forkhead box class O) 転写因子ファミリーは、代謝、アポトーシス、酸化ストレス耐性、老化に関与しています20-21。哺乳類ではFoxO1、FoxO3a、FoxO4、FoxO6の4つのFoxOタンパク質があります。FoxO1、FoxO3、FoxO4は様々な組織で広範囲に発現していますが、FoxO6の発現は主に神経細胞に限られます1-2,21。FoxO1とFoxO3aが活性化しているときは核タンパク質ですが、Aktの活性化によりFoxO1とFoxO3aはリン酸化し、非活性化し、細胞質との間を行ったり来たりします20-23。
FoxOファミリーのメンバーは免疫調節において重要な役割を果たしますが、それらの機能は広範囲に渡り、時には矛盾する場合があります20-21。FoxO1はNF-κBを活性化しますが、FoxO3aとFoxO4はNF-κBの活性を抑制することにより自己免疫疾患と炎症性疾患に抑制的な役割を果たす可能性があります21-23。全身性エリテマトーデス (Systemic lupus erythematosus:SLE) では、T細胞およびB細胞受容体の下流にあるFoxO1シグナル伝達系によってリンパ球の活性化/活性の亢進が調節され、免疫疾患を引き起こします20。FoxO3aはSLEの過程で発現抑制されます21。
mTORシグナル伝達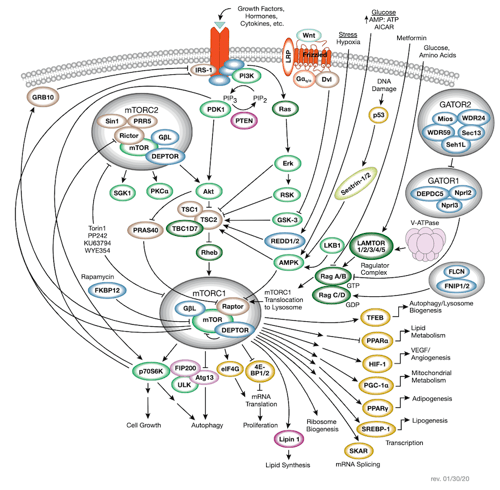
mTORシグナル伝達経路のインタラクティブパスウェイ図に含まれるCST ®抗体製品をご覧ください。
TSC-mTORC1
自己免疫疾患と全身性エリテマトーデス (母)
mTOR (mammalian Target Of Rapamycin) は、細胞の成長と代謝の調節において中心的な役割を果たす保存されたセリン/スレオニンキナーゼです (24)。mTORは、mTOR複合体1 (mTORC1) あるいはmTOR複合体2 (mTORC2) に組み込まれますが、この2つの複合体の構成因子は構造的に類似しているものの、その機能は異なります25。mTORC1は栄養素や成長因子、環境ストレスなどを感知することによって、栄養と代謝をリンクさせます24,25。mTORC2はAktの発現と活性化に関与しています25。
結節性硬化症複合体 (TSC) はTSC1とTSC2から構成される腫瘍抑制因子です24,25。TSCは転写またはオートファジーを調節することにより細胞代謝に影響を及ぼします25。悪条件においては、AMP活性化プロテインキナーゼ (AMPK) はTSC2をリン酸化し、TSC1-TSC2複合体の形成を促進してmTORC1活性を阻害します。AKTを介したリン酸化はTSC2を阻害し、その阻害を解除してmTORC1を活性化します1,25。
mTORC1の継続的な活性化はAktの脱リン酸化を引き起こし、mTORC1のフィードバックが抑制されます25。このように、mTORC1はAktの下流の活性化標的であると同時に、Aktへのネガティブフィードバック効果によるパスウェイ阻害因子でもあります1,24,25。
形質細胞は病原体に対する防御抗体を分泌しますが、全身性エリテマトーデス (SLE) などの自己免疫疾患においては体の細胞を標的とする病原性抗体 (自己抗体) も産生します (26)。mTORC1の過剰活性化は形質細胞および自己抗体の産生を増加させ、病気の発生を促進する可能性があります24-26。
PI3K/Aktのパズルを解く「クルー」
PI3K/Aktシグナル伝達が広範囲に及ぶことを考えると、Aktが様々な種類の細胞や組織の様々な刺激への応答において中心的かつ多様な役割を果たすことは不思議ではありません1-2。ただし、PI3K/Aktパスウェイは、より大規模なシグナル伝達ネットワークの要となる部分であり、すべてのシグナル伝達経路は状況に応じて変化することを心に留めておくことが重要です。病理学の視点から言えば、研究科学者と医学専門家は、ボードゲーム「クルー」のシグナル伝達版を毎日プレイしているようなものです。日々、彼らは「この病気の犯人が誰で、どのそうな細胞や器官で、どのようなシグナル伝達システムを利用しているのか」を探っています。
複雑なシグナル伝達ネットワークの解明の競争が続く中、科学者は常に研究をサポートするツールを必要としています。CSTは、このパズルの穴を埋めることができます。CSTの使命は、がんやトランスレーショナルリサーチに最も関連性が高く、有用で、再現性の高い製品を作ることです。研究者たちがこれらのシグナル伝達ネットワークを操作することで、いつか愛する人を苦しませる病気を治療できるように、CSTは信頼性の高いシグナル伝達ツールを科学者コミュニティに提供できるように努めています。
20-CEP-97405
参考文献:
- Manning BD, Toker A. AKT/PKB Signaling: Navigating the Network. Cell. 2017 Apr 20; 169(3): 381–405.
- Martini, Miriam & De Santis, Maria & Braccini, Laura & Gulluni, Federico & Hirsch, Emilio. (2014). PI3K/AKT Signaling pathway and cancer: An updated review. Annals of medicine. 46. 1-12
- Feng Y, Spezia M, Huang S, Yuan C, Zeng Z, Zhang L, Ji X, Liu W, Huang B, Luo W, Liu B, Lei Y, Du S, Vuppalapati A, Luu HH, Haydon RC, He TC, Ren G. Breast cancer development and progression: Risk factors, cancer stem cells, signaling pathways, genomics, and molecular pathogenesis. Genes Dis. 2018 May 12;5(2):77-106.
- Yip, C.C. and Ottensmeyer, P. (2003) J Biol Chem 278, 27329-32.
- Antonino Belfiore, Francesco Frasca, Giuseppe Pandini, Laura Sciacca, Riccardo Vigneri, Insulin Receptor Isoforms and Insulin Receptor/Insulin-Like Growth Factor Receptor Hybrids in Physiology and Disease, Endocrine Reviews, Volume 30, Issue 6, 1 October 2009, Pages 586–623.
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, Morrione A, Vigneri Insulin Receptor Isoforms in Physiology and Disease: An Updated View. Endocr Rev. 2017 Oct 1;38(5):379-431.
- Escribano O, Beneit N, Rubio-Longás C, López-Pastor AR, Gómez-Hernández A. The Role of Insulin Receptor Isoforms in Diabetes and Its Metabolic and Vascular Complications. J Diabetes Res. 2017;2017:1403206.
- Lizcano J. M. Alessi D. R. (2002) The insulin signaling pathway. Curr Biol. 12, 236-238.
- Alam F, Islam MA, Khalil MI, Gan SH. Metabolic Control of Type 2 Diabetes by Targeting the GLUT4 Glucose Transporter: Intervention Approaches. Curr Pharm Des. 2016;22(20):3034-3049.
- Mukohara T. PI3K mutations in breast cancer: prognostic and therapeutic implications. Breast Cancer (Dove Med Press). 2015;7:111‐123.
- Nwabo Kamdje A.H., Seke Etet P.F., Vecchio L., Muller J.M., Krampera M., Lukong K.E. Signaling pathways in breast cancer: therapeutic targeting of the microenvironment. Cell Signal. 2014;26(12):2843–2856.
- Thorpe LM,Yuzugullu H, Zhao JJ. PI3K in cancer: divergent roles of isoforms, modes of activation and therapeutic targeting. Nat Rev Cancer. 2015; 15: 7-24.
- Batlevi CL, Younes A. Revival of PI3K inhibitors in non-Hodgkin’s lymphoma. Annals of Oncology. 2017; 28(9): 2047-2049.
- Curran E, Smith SM. Phosphoinositide 3-kinase inhibitors in lymphoma. Curr Opin Oncol. 2014 Sep;26(5):469-75.
- Schatz, J.H. Targeting the PI3K/AKT/mTOR Pathway in Non-Hodgkin’s Lymphoma: Results, Biology, and Development Strategies. Curr Oncol Rep 13, 398 (2011).
- Blachly, J.S. and Baiocchi, R.A. (2014), Targeting PI3‐kinase (PI3K), AKT and mTOR axis in lymphoma. Br J Haematol, 167: 19-32.
- Lawrence J, Nho R. The Role of the Mammalian Target of Rapamycin (mTOR) in Pulmonary Fibrosis. Int J Mol Sci. 2018 Mar 8;19(3):778.
- Lei P, Ayton S, Bush AI, Adlard PA. GSK-3 in Neurodegenerative Diseases. Int J Alzheimers Dis. 2011:189-246.
- Kockeritz L, Doble B, Patel S, Woodgett JR. Glycogen synthase kinase-3--an overview of an over-achieving protein kinase. Curr Drug Targets. 2006 Nov; 7(11):1377-88.
- Hritzo Ahye MK, Golding A. Cytoplasmic FOXO1 identifies a novel disease-activity associated B cell phenotype in SLE Lupus Science & Medicine 2018;5:e000296.
- Lu M, Xu W, Gao B, Xiong S. Blunting Autoantigen-induced FOXO3a Protein Phosphorylation and Degradation Is a Novel Pathway of Glucocorticoids for the Treatment of Systemic Lupus Erythematosus. J Biol Chem. 2016 Sep 16;291(38):19900-12.
- Lin L, Hron JD, and Peng SL. (2004). Regulation of NF-κB, Th activation, and autoinflammation by the forkhead transcription factor Foxo3a. Immunity 21, 203–213.
- Zhou W, Cao Q, Peng Y, Zhang QJ, Castrillon DH, DePinho RA, and Liu ZP. (2009) FoxO4 inhibits NF-κB and protects mice against colonic injury and inflammation. Gastroenterology 137, 1403–1414.
- He J, Ma J, Ren b, Liu A. Advances in systemic lupus erythematosus pathogenesis via mTOR signaling pathway. Semin Arthritis Rheum. 2020 Apr;50(2):314-320.
- Stylianou K, I Petrakis, V Mavroeidi, S Stratakis, E Vardaki, K Perakis, et al. The PI3K/Akt/mTOR pathway is activated in murine lupus nephritis and downregulated by rapamycin. Nephrol Dialysis Transplant, 26 (2) (2011), pp. 498-508.
- Malkiel S, Barlev AN, Atisha-Fregoso Y, Suurmond J, Diamond B. Plasma Cell Differentiation Pathways in Systemic Lupus Erythematosus. Front Immunol. 2018 Mar 5;9:427.