6月は「がん免疫療法研究の啓発月間」であることをご存知ですか?2013年に、がん免疫療法がScience誌の「breakthrough of the year」に選ばれてから、今年で10年になります。免疫療法を用いて治療できるがんは30種類を超えていますが、この啓発月間は、治療可能ながんの種類をさらに増やし、より多くのがん患者に命を救う治療法をもたらすことを目標にしています。
免疫療法はどうやってがんを標的化するのか?
放射線療法や化学療法などの従来のがん治療は、がん細胞を除去することに重点を置いており、副作用によって身体的および精神的に衰弱したり、転移性がんではしばしば治療の成功が限られたりする場合があります。また、これらの治療法は長期寛解に至らず、がん患者は再発や治療に対する抵抗性を示すようになることもあります。
患者自身の免疫系が、がん細胞を認識して攻撃するように仕向ける免疫療法は、がんを消滅させる代替アプローチを提供します。異なる枠組みを用いることにより、転移性黒色腫や膵管腺がんなどの、従来のアプローチでは予後不良であったがんの生存率が向上しました。さらに免疫療法は、がん細胞が再度生じた場合に免疫系が認識することができるため、長期寛解を達成できる可能性があるという利点もあるため、持続的に、もしかすると永続的にがんから身を守ることができるかもしれません。
免疫療法は、バイデン政権が推進するCancer Moonshotプログラムにおいて大きな役割を担っています。このプログラムの目標は、「今後25年間でがんの死亡率を50%減少させて、がんと共に生きる、そしてがんから生還するという実例を増やす」ことです。米国議会は、このプログラムの一環として、免疫療法を含む基礎研究や患者を支援するツールに対して18億ドルを投資しました。がん研究所 (Cancer Research Institute) は、免疫療法の研究に対して4億ドルを出資し、国立がん研究所は、基礎科学研究から臨床研究への応用に至るまで、継続的な資金提供を行うことにより免疫療法を支援し続けています。
現在、免疫療法は何種類存在するのか?
現在、様々な種類の免疫療法があります:
- 免疫チェックポイント阻害剤:がんが免疫系を回避するために用いる、免疫チェックポイントを阻害します。
- 免疫調節薬: がんと効果的に闘うために、身体の免疫応答を刺激します。がん治療に用いられる免疫調節薬には、各種サイトカインやアゴニスト、アジュバントがあります。
- 養子細胞療法: 患者から免疫細胞を単離し、特定の細胞集団を増殖させる、あるいはがん抗原を認識するように改変します。養子細胞療法には、CAR-T療法や腫瘍浸潤リンパ球 (TIL) 療法、改変T細胞受容体療法、ナチュラルキラー (NK) 細胞療法などがあります。
- 標的抗体: がん特異的抗原に対するモノクローナル抗体を用います。単一特異性抗体や二重特異性抗体、細胞傷害性薬物と結合した複合体などがあります。
- 腫瘍溶解性ウイルス療法: がん細胞以外の細胞に影響を与えることなく、がん細胞に特異的に感染して殺すようにウイルスを改変します。米国食品医薬品局 (FDA) は、腫瘍への直接注入により転移性黒色腫細胞を死滅させる、改変ヘルペスウイルスIMLYGICを承認しています。
- がんワクチン: 既知のがんを認識するように免疫系を訓練する、またはウイルスが引き起こすがんの発生を防ぎます。FDAは、子宮頸がんや肝臓がんを予防するワクチン、前立腺がん、転移性黒色腫、早期膀胱がんを治療するワクチンを承認しています。
T細胞の詳細や、他の免疫細胞タイプの挙動、それらのがん細胞との相互作用などが明らかになるにつれ、免疫療法や特異的な治療法の種類は拡大します。
がん免疫療法研究の中で、何が注目されているのか?
免疫チェックポイント阻害剤
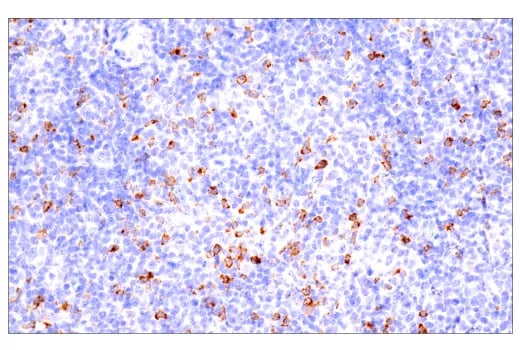
近年、免疫チェックポイント阻害剤が注目を集めており、2018年には、がん細胞がCTLA-4とPD-1を用いて免疫系を回避する仕組みを発見したJames Allison博士と本庶佑博士にノーベル賞が贈られました。しかし、この2つの分子の作用機序は異なります。CTLA-4は通常、共刺激分子CD28とのリガンド結合の競合を介してT細胞の初回抗原刺激を制限し、免疫応答を抑制するために用いられる免疫抑制分子です。2011年にFDAが承認した最初の免疫チェックポイント阻害剤であるIpilimumabは、CTLA-4を阻害し、T細胞が腫瘍抗原に対して応答できるようにします。
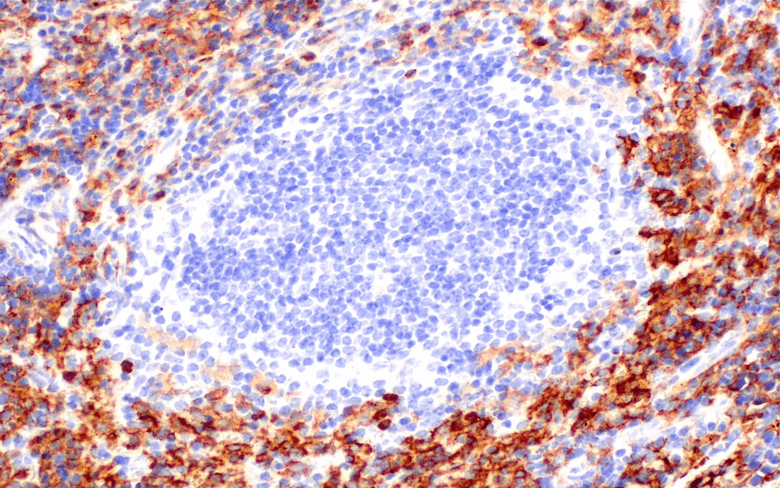
パラフィン包埋したヒトB細胞非ホジキンリンパ腫をCTLA-4 (E2V1Z) Rabbit mAb #53560を用いて免疫組織化学染色を行い、Leica Biosystems社の BOND Rx Fully Automated Research Stainerで解析しました。
一方、PD-1は抗原刺激を受けたT細胞に発現しており、がん微小環境 (TME) 中の腫瘍細胞や骨髄細胞に発現する PD-L1と相互作用し、T細胞の活性を阻害します。PembrolizumabとNivolumabはいずれも、TMEや腫瘍そのものに発現しているPD-1とPD-L1の相互作用を阻害し、疲弊したT細胞の機能を回復させます。
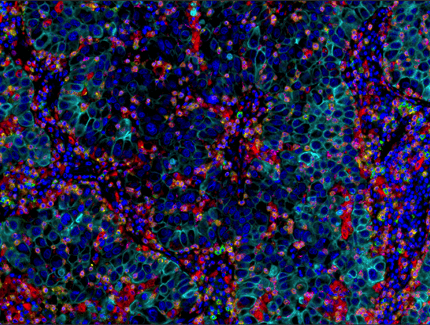 パラフィン包埋したヒト肺腺がん組織を、PD-1 (EH33) Mouse mAb #43248 (緑)、 CD8α (C8/144B) mouse mAb #70306 (マゼンタ)、 CD68 (D4B9C) XP® rabbit mAb #76437 (赤)、 Pan-keratin (C11) mouse mAb #4545 (シアン)、LAG3 (D2G4O™) XP® rabbit mAb #15372 (橙)、TIM-3 (D5D5R™) XP® rabbit mAb #45208 (黄) を用いてマルチプレックス免疫組織化学染色し、解析しました。
パラフィン包埋したヒト肺腺がん組織を、PD-1 (EH33) Mouse mAb #43248 (緑)、 CD8α (C8/144B) mouse mAb #70306 (マゼンタ)、 CD68 (D4B9C) XP® rabbit mAb #76437 (赤)、 Pan-keratin (C11) mouse mAb #4545 (シアン)、LAG3 (D2G4O™) XP® rabbit mAb #15372 (橙)、TIM-3 (D5D5R™) XP® rabbit mAb #45208 (黄) を用いてマルチプレックス免疫組織化学染色し、解析しました。
- しかし、免疫チェックポイント阻害剤による治療が成功するのは一部のがん患者のみです。そのため、免疫チェックポイント阻害剤と、他の免疫チェックポイント阻害剤または異なる治療法を併用した場合の有効性や安全性を評価する取り組みが行われています。例えば、PD-1阻害剤であるNivolumabとCTLA-4阻害剤であるIpilimumabの併用療法は、転移性非小細胞肺がん (NSCLC) の治療薬として承認されています。さらに近年、別の免疫チェックポイントタンパク質であるLAG3を阻害するRelatlimabが、PD-1阻害剤Nivolumabと併用する切除不能または転移性黒色腫の治療薬としてFDAから承認されました。
標的抗体を用いた免疫療法
標的抗体は、標的分子の機能の阻害や、アポトーシスの誘導、シグナル伝達経路の調節に用いられます。例えば、モノクローナル抗体であるあHerseptinは、乳がんや胃がんにおいて過剰発現しているHER2受容体に結合し、下流のシグナル伝達経路を抑制することによりアポトーシスの誘導や細胞増殖の阻止を行います。乳がんの約25%がHER2陽性であるため、HER2は現在のがん治療における強力な「特効薬」となっています2。Herceptinは1998年に承認されましたが、研究者は引き続き、異なるエピトープや結合力を改善するための抗体の改変に関する研究を行い、効果がより高い、または毒性の低い治療法を模索しています。また、抗体を化学療法に用いるペイロードに結合させて (抗体薬物複合体)、細胞障害性分子による腫瘍の特異的な標的化も可能です。最後に、二重特異性抗体は、2つの異なる抗体の可変領域を1つの分子に組み合わせ、複数のエピトープ、例えば、がん細胞とT細胞などを認識できるようにする新たな手法です。この二特異性抗体は、T細胞を腫瘍に接近させて、T細胞の活性化、増殖を誘導し、T細胞を介してがん細胞を殺します。初の二重特異性抗体であるBlinatumomabは、2014年に白血病患者の治療薬としてFDAに承認されました。
多くの標的抗体療法において、免疫系を刺激するために免疫グロブリンG (IgG) とT細胞が用いられています。しかし、免疫療法のレパートリーを広げるために、他の免疫細胞や免疫グロブリンタイプに着目する研究が現在行われています。例を挙げると、黒色腫の70%以上にみられるCSPG4 (Chondroitin sulfate proteoglycan 4)を標的とする免疫グロブリンE (IgE) を用いた研究では、マウスで有望な結果が得られています3。IgE抗体は通常、花粉などのアレルゲンに応答します。すべてではありませんが、IgEをベースとする治療法は、IgGをベースとする治療法に比べFceRI受容体に対する高い親和性、IgEの抑制性受容体の欠如、IgGとは異なるエフェクター細胞の応答を誘導する能力、血液中の細胞内における低い発現量などの利点があるため、受容体への結合競争が低く、補体依存性細胞傷害 (CDC) を伴わない抗体依存性細胞傷害 (ADCC) を媒介します4。
養子細胞療法
養子細胞療法は個別化医療の一形態であり、生体外で患者またはドナーの免疫細胞を増殖させる、または改変し、免疫細胞が腫瘍細胞を認識して殺すことができるようにします。 その後、改変した細胞を患者に再注入します。しばしば「生きた薬」とも呼ばれる養子細胞療法には、腫瘍浸潤リンパ球 (TIL) やキメラ抗原受容体 (CAR) T細胞療法が含まれます5。
TILは、腫瘍を認識し、腫瘍に浸潤したものの、腫瘍やTMEからのシグナルによって免疫抑制されている血液細胞です。複数のがん抗原を認識するTILの集団を腫瘍の生検サンプルから単離し、増殖された後に患者に注入し、腫瘍を探して破壊させます。Interleukin 2 (IL-2)および化学療法と併用されるTILの有効性と安全性は、黒色腫や他の固形がんの治療に極めて有望です5。しかし、治療を成功させるために必要な数のTILを増殖させるには数カ月かかることがあり、すべての患者さんにそのような時間があるわけではありません。単離されたTILの中には、増殖が難しいものや、強いエフェクター応答を示さないものもあります。現在、TILと免疫チェックポイント阻害剤を用いた併用療法の研究が行われています。また、FDAは、この有望なアプローチの恩恵を受けられる患者の数を増やすために、IL-2なしで有効になるように改変した改変TILの新薬申請を承認しました。
CAR-T療法は、悪性度の高い白血病やリンパ腫の治療において、奏効率と持続的寛解の頻度が高いことが証明されているため、養子細胞療法の中で最も注目されています。CAR-T細胞は、腫瘍抗原を認識し腫瘍の細胞死を誘導する細胞表面受容体を発現するように改変された、患者から採取した免疫細胞です。FDAは、6種類のCAR-T療法を承認しており、小児では急性リンパ芽球性白血病、成人ではB細胞リンパ腫、濾胞性リンパ腫、マントル細胞リンパ腫、多発性骨髄腫がその対象となっています。しかし、腫瘍特異的抗原の特定やTMEの免疫抑制性の性質、CAR-Tに関連する有害性などの課題があるため、固形がんに対するCAR-T療法の成功にはまだ満たされていないニーズがあります6。免疫チェックポイント阻害薬とCAR-T細胞を併用した患者の治療や、TMEに特異的な免疫抑制性シグナルに耐性を持つ改変CARなど、TMEによる影響を軽減するための研究が、現在精力的に行われています。
CAR-T療法の普及を阻むもう1つの要因は、T細胞を分離し、CARを発現するように改変し、CARの細胞表面の発現を検証するのに時間がかかることです。残念ながら、必要な特異性を持つ検出試薬が入手困難な場合、CARの細胞表面の発現のモニタリングは複雑になる可能性があります。この問題を回避する方法の1つとして、scFv上の重鎖可変領域と軽鎖可変領域間のリンカー配列を認識する抗CARリンカー抗体を用いて、抗原非依存的にCAR-Tを検証する方法があります。
がんワクチン
緊急性を要していたCOVID-19のワクチン開発は、大きな発見と免疫系に対する理解の深まりをもたらし、その技術は、現在ではがんワクチンに応用されています7。当初は有望な治療法であったものの、2010年代にはすべて中止されていた去勢抵抗性前立腺がんと高リスクの筋層浸潤性膀胱がん (NMIBC) に対する免疫応答を促進する治療用ワクチンが、現在FDAによって承認されています7。核酸ワクチン技術の出現は、製造にかかる時間や免疫不全患者における弱毒化生ワクチンの使用との兼ね合いなどの課題を解決しました。予防ワクチンも開発されており、特に子宮頸がんを予防するヒトパピローマウイルス (HPV) ワクチンや、肝臓がんを予防するB型肝炎ウイルスワクチンが有名です。非ウイルス性のがんの予防ワクチンはまだ臨床段階には至っていません。しかし、研究者たちは、がんが進行する前に、抗がん免疫を促進するための改善された診断・スクリーニングツールを、治療用ワクチンと併用できるかどうかを研究しています。
がん研究の有望な未来
免疫療法は、患者に対して治療の選択肢を増やしたものの、決してがんを一発で治す万能薬ではありません。手術や化学療法、放射線療法などの従来の治療法と、上記の免疫療法を併用することにより、臨床医は個々の患者に効果的な治療戦略を立てることができます。
斬新かつ魅力的なブレークスルーもまた、探求され続けています。例えば、近年の研究では、腸内のマイクロバイオームを微調整することにより、患者の治療応答性を改善できることが示唆されています。研究者が、マウスの大腸にがん患者由来のマイクロバイオームを播種したところ、治療応答性と相関するPD-L2とRGMbタンパク質の発現量の変化が認められました8。さらに、腸内細菌を死滅させるために広域性の抗生物質をマウスに投与することで、抗PD-1免疫療法に対する応答が低下しました。このことは、患者の腸にマイクロバイオームを播種することにより、免疫療法に応答する患者の数を増やすことができることを示唆しています。
免疫療法は、がん治療の状況を変え、臨床医が選択できる治療法の選択肢を増やしました。免疫系についてより深く学び、制御機構を利用する革新的な戦略を考えるにつれ、選択肢はますます増えていくことでしょう。がんを予防し、転移性のがんを完治できる日が近づいています。
さらなる詳細はこちら:CSTが提供するツールと参考文献をご覧ください
- ポスター:免疫腫瘍学シグナル伝達経路
- 研究リソースページ:がん免疫の重要な標的タンパク質
- 研究リソースページ:CAR-T療法研究用のツール:有効な治療法のより迅速な開発をサポート
- 関連ブログ:抗CARリンカーモノクローナル抗体
- パンフレット:Solutions for Therapeutic Discovery
参考文献
- Puhr HC, Ilhan-Mutlu A. New emerging targets in cancer immunotherapy: the role of LAG3. ESMO Open. 2019;4(2):e000482. Published 2019 Mar 12 doi: 10.1136/esmoopen-2018-000482.
- Costa RLB, Czerniecki BJ. Clinical development of immunotherapies for HER2+ breast cancer: a review of HER2-directed monoclonal antibodies and beyond. NPJ Breast Cancer. 2020;6:10. Published 2020 Mar 12 doi:10.1038/s41523-020-0153-3
- Chauhan J, et al. Anti-cancer pro-inflammatory effects of an IgE antibody targeting the melanoma-associated antigen chondroitin sulfate proteoglycan 4. Nat Commun. 2023;14(1):2192. Published 2023 Apr 25 doi: 10.1038/s41467-023-37811-3.
- Leoh LS, Daniels-Wells TR, Penichet ML. IgE immunotherapy against cancer. Curr Top Microbiol Immunol. 2015;388:109-49.
- Kirtane K, Elmariah H, Chung CH, Abate-Daga D. Adoptive cellular therapy in solid tumor malignancies: review of the literature and challenges ahead. J Immunother Cancer. 2021;9(7):e002723. doi:10.1136/jitc-2021-002723.
- Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021;11(4):69. Published 2021 Apr 6. doi:10.1038/s41408-021-00459-7.
- Grimmett E, Al-Share B, Alkassab MB, Zhou RW, Desai A, Rahim MMA, Woldie I. Cancer vaccines: past, present and future; a review article. Discov Oncol. 2022;13(1):31. Published 2022 May 16 doi:10.1007/s12672-022-00491-4
- Park JS, Gazzaniga FS, Wu M, et al. Targeting PD-L2-RGMb overcomes microbiome-related immunotherapy resistance [published correction appears in Nature. 2023 Jun 1;:]. Nature. 2023;617(7960):377-385. doi:10.1038/s41586-023-06026-3
Cell Signaling Technologyのマルチプレックスアッセイ開発部門アソシエートダイレクター、Sarah Klein博士が本記事の執筆とレビューを行いました。
23-CAN-85660