成人の急性白血病の約80%を占める急性骨髄性白血病 (AML) は、クローン性造血幹細胞および前駆細胞の無秩序な増殖を特徴とする悪性度の高い血液がんです1,2。この疾患は、初期であれば多くの場合に化学療法が奏効するため、この数十年の間に予後が大幅に改善されましたが、白血病細胞の免疫回避メカニズムの活性化や化学療法抵抗性クローンの出現による再発率は依然としてかなり高い水準にあります3-5。
しかし、AMLのエピゲノムを標的とする新しいクラスの薬物が、この悪性度の高い疾患の治療に新たな希望をもたらしています。中でもMenin阻害剤は、特にLysine methyltransferase 2A (KMT2A) の再構成やNucleophosmin 1 (NPM1) の遺伝子突然変異といった特定の遺伝的変異を持つAMLサブタイプの有望な治療薬として期待されています。
Menin-KMT2A阻害剤はどのように作用するか?本ブログ記事では、現在臨床試験中の新たなAMLの治療戦略の概要と作用機序について解説し、その主な標的と、この疾患の研究に使用可能なCST®抗体を紹介します。
<<Jump to the end of this post for a list of relevant CST products>>
AMLエピゲノムと薬物の作用機序
AMLは、突然変異による荷重が非常に低い遺伝的に不均一な疾患です。また、AMLは、他の疾患に比べて少数の突然変異により誘導されますが、興味深いことに、これらの突然変異はその多くがクロマチンやエピジェネティック調節因子に生じています。さらに、AMLの白血病の誘発を促進する多くの発がん性融合タンパク質は、エピジェネティック調節因子の発現異常や特異性の転換などを介して機能します。したがって、AMLのエピゲノムの標的化は、より効果的な治療法を発見するための非常に有望な手段として注目されています。
 NPM1遺伝子変異 (左) とKMT2A再構成 (右) がAMLを誘導するメカニズムを示しています。NPM1遺伝子の変異体であるNPM1c遺伝子変異と、再発または難治性の原因となる特定の遺伝子の共変異を有する成人AML患者の予後は不良です。NPM1cは、AML症例の約30%を占め、OS率 (5年全生存率) は約50%です。また、KMT2Ar (KMT2A再構成) を有する成人AML患者も予後不良であり、現在の標準治療では高い確率で耐性と再発を示します。KMT2Arは、AML症例の5 - 10%を占め、KMT2Arを有するAML患者のOS率は20%未満です。
NPM1遺伝子変異 (左) とKMT2A再構成 (右) がAMLを誘導するメカニズムを示しています。NPM1遺伝子の変異体であるNPM1c遺伝子変異と、再発または難治性の原因となる特定の遺伝子の共変異を有する成人AML患者の予後は不良です。NPM1cは、AML症例の約30%を占め、OS率 (5年全生存率) は約50%です。また、KMT2Ar (KMT2A再構成) を有する成人AML患者も予後不良であり、現在の標準治療では高い確率で耐性と再発を示します。KMT2Arは、AML症例の5 - 10%を占め、KMT2Arを有するAML患者のOS率は20%未満です。
KMT2A再構成やNPM-1突然変異を有するAMLの白血病を誘導する転写プログラムを標的とするMenin阻害剤は、現在臨床試験中です1,2。 このクラスの阻害剤は、クロマチンアダプタータンパク質であるMeninとKMT2A複合体の間の重要な相互作用を阻害し、最終的に白血病細胞の分化とアポトーシスを誘導します。非常に興味深いことに、この新しいクラスの薬剤を単独で、あるいは他の相乗効果のある薬剤と組み合わせて試験した第I相および第II相臨床試験では、これらの前治療を実施した急性白血病患者における安全性と奏効率に関して有望な結果が得られています6,7。
AMLにおけるMenin依存性とKMT2A再構成
KMT2Aは、Mixed Lineage Leukemia 1 (MLL1) としても知られており、1992年に行われたヒト11q23白血病で破壊されている遺伝子のクローニングの際に発見された、ショウジョウバエのTrithoraxの哺乳類ホモログです8 - 12。 このがん原遺伝子は、非常に大きなメチルトランスフェラーゼ (500kDa) をコードしており、重要なエピジェネティックコアクチベーターとして機能し、胚発生や造血における重大な役割を担っています。非常に注目すべきことに、KMT2Aは、一部の急性白血病で遺伝子が破壊されて染色体転座が起きています。実際に、KMT2A再構成 (KMT2Ar) は、急性白血病の約10%、そして小児白血病の70 - 80%にみられます13,14。 また、治療関連白血病の約70%にもKMT2Arがみられます15,16。
白血病を引き起こすこれらの再構成は、KMT2Aタンパク質のN末端と80種類以上のパートナー遺伝子がインフレームで融合することにより生じます。これらの融合相手となる遺伝子の多くは転写コファクターそのものであり、AF4やAF9、MLLT1/ENLなどが含まれます。KMT2Ar白血病では、これらの融合タンパク質はヒストンメチル化酵素DOT1Lやアンカー型タンパク質Meninなどを含む、クロマチン関連複合体と相互作用し、造血細胞の増殖や分化に不可欠な遺伝子の発現を亢進します17。
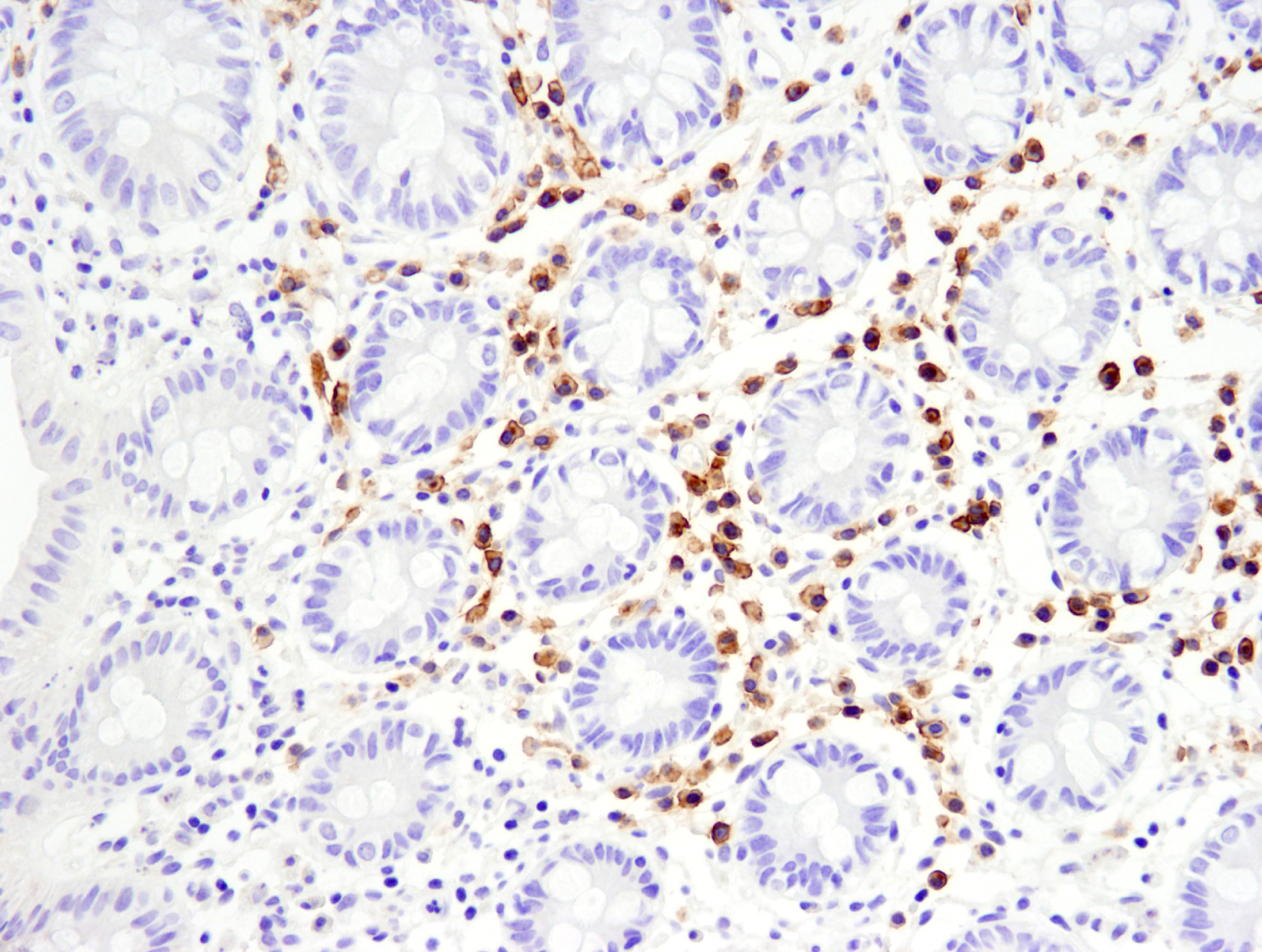
 野生型 (左、ポジティブ) およびMLL (-/-) (右、ネガティブ) のMEFを、MLL (D6G8N) Rabbit mAb (Carboxy-terminal Antigen) #14197 (緑) を用いて蛍光免疫染色し、共焦点顕微鏡で解析しました。アクチンフィラメントをDyLight™ 554 Phalloidin #13054 (赤) で染色しました。MLL1 WT MEFとMLL1 KO MEFは、ノースウェスタン大学のAli Shilatifard博士のご厚意により提供いただきました。
野生型 (左、ポジティブ) およびMLL (-/-) (右、ネガティブ) のMEFを、MLL (D6G8N) Rabbit mAb (Carboxy-terminal Antigen) #14197 (緑) を用いて蛍光免疫染色し、共焦点顕微鏡で解析しました。アクチンフィラメントをDyLight™ 554 Phalloidin #13054 (赤) で染色しました。MLL1 WT MEFとMLL1 KO MEFは、ノースウェスタン大学のAli Shilatifard博士のご厚意により提供いただきました。
KMT2A融合タンパク質の直接的な治療標的化はまだ達成されていませんが、発がん性融合タンパク質複合体のメンバーを標的とすることにより、疾患の進行を抑制できるという有望な結果が得られています。KMT2Arにおける白血病の発症および維持に必要なDOT1Lの酵素阻害は、有望な治療法となる可能性が非臨床研究で示されています。しかし、DOT1Lの阻害は、単剤で使用した場合、初期の臨床試験ではわずかな活性しか示しません18。 白血病の転写プログラムを活性するMeninの機能的な役割を考えると19,20、Menin-KMT2A相互作用を標的とする低分子阻害剤はKMT2Arの治療薬として非常に有望です21,22。より詳細に述べると、Meninは、すべてのKMT2A融合タンパク質が持つKMT2AのN末端内の高度に保存された領域と直接相互作用します。この相互作用により、融合タンパク質複合体のクロマチンへの結合が促進され、KMT2Ar AMLの発症に重要なHOXA9やMEIS1などの主要な標的の転写異常が引き起こされます23,24。
Menin-KMT2Aタンパク質相互作用を阻害すると、クロマチン上でのKMT2A融合タンパク質複合体のアセンブリが阻害されます。非臨床試験では、Meninの阻害がHOXA9とMEIS1の発現を抑制することにより、KMT2Ar白血病モデルにおいて白血病の発症を抑えることができることが立証されています21,25。 興味深いことに、このクラスのMenin阻害剤はこれらのタンパク質のmRNAレベルを変化させることなく総量を減少させることが分かっています。KMT2Ar白血病細胞では、Menin阻害剤はユビキチンリガーゼCHIPとの相互作用を促進し、Meninのユビキチン化とそれに続く分解を増加させます26。 この分解の臨床的な有用性はまだ分かっていませんが、現時点で少なくとも6種類のMenin-KMT2A阻害剤(DS-1594、BMF-219、JNJ-75276617、DSP-5336、Ziftomenib、Revumenib) が急性白血病に対する臨床試験を受けており、ZiftomenibおよびRevumenibについては、有望な早期奏功データが報告されています6,7。
AMLおよび他の白血病におけるMenin依存性とNPM1遺伝子変異
NPM1遺伝子の変異もまた、白血病発症の主な促進因子です。実際に、NPM1遺伝子変異は急性白血病の30%にみられる、成人AMLにおいて最も一般的な遺伝子変異です27。 NPM1は、核と細胞質の間を行き来 (シャトリング) するシャペロンタンパク質ですが、主に核に局在し、様々な生物学的機能を担っています。野生型NPM1のシャトリングは、2つの核外移行シグナル (NES)、双節型核移行シグナル (NLS)、C末端の核小体移行シグナルに媒介されます。NPM1遺伝子のエクソン12における変異の挿入は最も一般的であり、その結果、C末端に新しいNESが生じ、最終的に変異型NPM1 (NPM1c) は本来とは異なる細胞質に安定して局在します28,29。 NPM1の多様な役割から、NPM1cの誤った局在は白血病発症の促進に大きな影響を与えると考えられます。
NPM1c AMLとKMT2Ar白血病は類似した遺伝子発現プロファイルを示し、NPM1c AMLでは、野生型KMT2AとMeninの相互作用がHOXA9およびMEIS1による白血病発症を誘導します30,31。 Meninは、KMT2Ar白血病と同様にNPM1c AMLの進行と生存率に関与する重要な役割を担っており、Menin阻害剤は、NPM1c白血病モデルにおいて野生型KMT2A複合体を不安定化させることに成功しています30,31。 実際に、現在進行中の上述したMenin阻害剤の臨床試験では、NPM1cを有する再発または難治性の急性白血病患者における安全性と有効性が調査されており、同様の有望な結果が得られています6,7。
混合形質型白血病 (MLL) 治療の今後の方向性
これまでの内容をまとめると、Menin阻害剤は、KMT2ArおよびNPM1c白血病に対する非常に有望な新しいクラスの薬剤であり、間接的に発がんに関与するタンパク質複合体を標的とすることの重要性が注目されています。さらに、HOXA9とMEIS1が過剰発現している白血病の他のサブセット、例えばNucleoporin 98 (NUP98) 再構成を有する白血病も、Menin阻害に応答する可能性があります32。Menin阻害と相乗効果を示すと思われるBCL-2阻害剤やFLT3阻害剤のような合理的な併用療法を特定することが、治療への応答を向上させて耐性を予防するために重要です。
AML研究用のCST抗体
CSTは、Menin-MLL阻害剤の研究用に、高度に検証済された数多くのKMT2A/MLL抗体製品を提供しています。標的や特定のアプリケーションごとにまとめた以下のリストから、関連製品を探索してください。
| 標的 | 製品 | アプリケーション |
| Menin | Menin (E5P1R) Rabbit mAb #19893 | ChIP, IHC, WB, IP |
| Menin | Menin (D45B1) XP® Rabbit mAb #6891 | IF, WB |
| DOT1L | DOT1L (D1W4Z) Rabbit mAb #77087 | ChIP, CUT&RUN, WB, IP |
| MLL1/ENL | MLLT1/ENL (D9M4B) Rabbit mAb #14893 | ChIP, CUT&RUN, WB |
| MLL C-Terminal |
MLL1 (D6G8N) Rabbit mAb (Carboxy-terminal Antigen) #14197 | IF, WB, IP |
| MLL N末端 |
MLL1 (D2M7U) Rabbit mAb (Amino-terminal Antigen) #14689 | CUT&RUN, CUT&Tag, WB, IP |
| NPM1 | NPM1 (E7W4P) Rabbit mAb #92825 | IHC, IF, WB |
| NPM1c | NPM1 (C Mutant Specific) Antibody #17944 | ChIP, WB, IP |
| NUP98 | NUP98 (C39A3) Rabbit mAb #2598 | IF, WB, IP |
| NUP98 | NUP98 (C37G10) Rabbit mAb #2597 | WB, IP |
| NUP98 | NUP98 (L205) Antibody #2288 | WB |
参考文献
- DiNardo CD, Erba HP, Freeman SD, Wei AH. Acute myeloid leukaemia. Lancet. 2023;401(10393):2073-2086. doi:10.1016/S0140-6736(23)00108-3
- Shimony S, Stahl M, Stone RM. Acute myeloid leukemia: 2023 update on diagnosis, risk-stratification, and management. Am J Hematol. 2023;98(3):502-526. doi:10.1002/ajh.26822
- Lokody I. Drug resistance: Overcoming resistance in acute myeloid leukaemia treatment. Nat Rev Cancer. 2014;14(7):452-453. doi:10.1038/nrc3776
- Vago L, Perna SK, Zanussi M, et al. Loss of mismatched HLA in leukemia after stem-cell transplantation. N Engl J Med. 2009;361(5):478-488. doi:10.1056/NEJMoa0811036
- Toffalori C, Zito L, Gambacorta V, et al. Immune signature drives leukemia escape and relapse after hematopoietic cell transplantation. Nat Med. 2019;25(4):603-611. doi:10.1038/s41591-019-0400-z
- Issa GC, Aldoss I, DiPersio J, et al. The menin inhibitor revumenib in KMT2A-rearranged or NPM1-mutant leukaemia. Nature. 2023;615(7954):920-924. doi:10.1038/s41586-023-05812-3
- Candoni A, Coppola G. A 2024 Update on Menin Inhibitors. A New Class of Target Agents against KMT2A-Rearranged and NPM1-Mutated Acute Myeloid Leukemia. Hematol Rep. 2024;16(2):244-254. Published 2024 Apr 18. doi:10.3390/hematolrep16020024
- Gu Y, Nakamura T, Alder H, et al. The t(4;11) chromosome translocation of human acute leukemias fuses the ALL-1 gene, related to Drosophila trithorax, to the AF-4 gene. Cell. 1992;71(4):701-708. doi:10.1016/0092-8674(92)90603-a
- Tkachuk DC, Kohler S, Cleary ML. Involvement of a homolog of Drosophila trithorax by 11q23 chromosomal translocations in acute leukemias. Cell. 1992;71(4):691-700. doi:10.1016/0092-8674(92)90602-9
- Ziemin-van der Poel S, McCabe NR, Gill HJ, et al. Identification of a gene, MLL, that spans the breakpoint in 11q23 translocations associated with human leukemias [published correction appears in Proc Natl Acad Sci U S A 1992 May 1;89(9):4220]. Proc Natl Acad Sci U S A. 1991;88(23):10735-10739. doi:10.1073/pnas.88.23.10735
- Domer PH, Fakharzadeh SS, Chen CS, et al. Acute mixed-lineage leukemia t(4;11)(q21;q23) generates an MLL-AF4 fusion product. Proc Natl Acad Sci U S A. 1993;90(16):7884-7888. doi:10.1073/pnas.90.16.7884
- Thirman MJ, Gill HJ, Burnett RC, et al. Rearrangement of the MLL gene in acute lymphoblastic and acute myeloid leukemias with 11q23 chromosomal translocations. N Engl J Med. 1993;329(13):909-914. doi:10.1056/NEJM199309233291302
- Meyer C, Hofmann J, Burmeister T, et al. The MLL recombinome of acute leukemias in 2013. Leukemia. 2013;27(11):2165-2176. doi:10.1038/leu.2013.135
- Mann G, Attarbaschi A, Schrappe M, et al. Improved outcome with hematopoietic stem cell transplantation in a poor prognostic subgroup of infants with mixed-lineage-leukemia (MLL)-rearranged acute lymphoblastic leukemia: results from the Interfant-99 Study. Blood. 2010;116(15):2644-2650. doi:10.1182/blood-2010-03-273532
- Blanco JG, Dervieux T, Edick MJ, et al. Molecular emergence of acute myeloid leukemia during treatment for acute lymphoblastic leukemia. Proc Natl Acad Sci U S A. 2001;98(18):10338-10343. doi:10.1073/pnas.181199898
- Chowdhury T, Brady HJ. Insights from clinical studies into the role of the MLL gene in infant and childhood leukemia. Blood Cells Mol Dis. 2008;40(2):192-199. doi:10.1016/j.bcmd.2007.07.005
- Dafflon C, Craig VJ, Méreau H, et al. Complementary activities of DOT1L and Menin inhibitors in MLL-rearranged leukemia. Leukemia. 2017;31(6):1269-1277. doi:10.1038/leu.2016.327
- Stein EM, Garcia-Manero G, Rizzieri DA, et al. The DOT1L inhibitor pinometostat reduces H3K79 methylation and has modest clinical activity in adult acute leukemia. Blood. 2018;131(24):2661-2669. doi:10.1182/blood-2017-12-818948
- Caslini C, Yang Z, El-Osta M, Milne TA, Slany RK, Hess JL. Interaction of MLL amino terminal sequences with menin is required for transformation. Cancer Res. 2007;67(15):7275-7283. doi:10.1158/0008-5472.CAN-06-2369
- Cierpicki T, Grembecka J. Challenges and opportunities in targeting the menin-MLL interaction. Future Med Chem. 2014;6(4):447-462. doi:10.4155/fmc.13.214
- Grembecka J, He S, Shi A, et al. Menin-MLL inhibitors reverse oncogenic activity of MLL fusion proteins in leukemia. Nat Chem Biol. 2012;8(3):277-284. Published 2012 Jan 29. doi:10.1038/nchembio.773
- Xu Y, Yue L, Wang Y, et al. Discovery of Novel Inhibitors Targeting the Menin-Mixed Lineage Leukemia Interface Using Pharmacophore- and Docking-Based Virtual Screening. J Chem Inf Model. 2016;56(9):1847-1855. doi:10.1021/acs.jcim.6b00185
- Armstrong SA, Staunton JE, Silverman LB, et al. MLL translocations specify a distinct gene expression profile that distinguishes a unique leukemia. Nat Genet. 2002;30(1):41-47. doi:10.1038/ng765
- Krivtsov AV, Armstrong SA. MLL translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer. 2007;7(11):823-833. doi:10.1038/nrc2253
- Krivtsov AV, Evans K, Gadrey JY, et al. A Menin-MLL Inhibitor Induces Specific Chromatin Changes and Eradicates Disease in Models of MLL-Rearranged Leukemia. Cancer Cell. 2019;36(6):660-673.e11. doi:10.1016/j.ccell.2019.11.001
- Wu Y, Doepner M, Hojnacki T, et al. Disruption of the menin-MLL interaction triggers menin protein degradation via ubiquitin-proteasome pathway. Am J Cancer Res. 2019;9(8):1682-1694. Published 2019 Aug 1.
- Papaemmanuil E, Gerstung M, Bullinger L, et al. Genomic Classification and Prognosis in Acute Myeloid Leukemia. N Engl J Med. 2016;374(23):2209-2221. doi:10.1056/NEJMoa1516192
- Falini B, Bolli N, Shan J, et al. Both carboxy-terminus NES motif and mutated tryptophan(s) are crucial for aberrant nuclear export of nucleophosmin leukemic mutants in NPMc+ AML. Blood. 2006;107(11):4514-4523. doi:10.1182/blood-2005-11-4745
- Bolli N, Nicoletti I, De Marco MF, et al. Born to be exported: COOH-terminal nuclear export signals of different strength ensure cytoplasmic accumulation of nucleophosmin leukemic mutants. Cancer Res. 2007;67(13):6230-6237. doi:10.1158/0008-5472.CAN-07-0273
- Kühn MW, Song E, Feng Z, et al. Targeting Chromatin Regulators Inhibits Leukemogenic Gene Expression in NPM1 Mutant Leukemia. Cancer Discov. 2016;6(10):1166-1181. doi:10.1158/2159-8290.CD-16-0237
- Uckelmann HJ, Kim SM, Wong EM, et al. Therapeutic targeting of preleukemia cells in a mouse model of NPM1 mutant acute myeloid leukemia. Science. 2020;367(6477):586-590. doi:10.1126/science.aax5863
- Heikamp EB, Henrich JA, Perner F, et al. The menin-MLL1 interaction is a molecular dependency in NUP98-rearranged AML. Blood. 2022;139(6):894-906. doi:10.1182/blood.2021012806
For Research Use Only. Not for Use in Diagnostic Procedures. 24-HMC-54350