生体モデルを用いた、タンパク質の機能を研究するための基礎的なアプローチである遺伝子編集とRNA干渉 (RNAi) は、意図していない非特異的な不具合による表現型の変化を引き起こしたり、特定の細胞株への導入が難しい場合があります。しかし、タンパク質分解に複雑な手法を用いる必要はありません。研究室のセットアップを変更したり、新しいトレーニングや機器にコストを費やすことなく、迅速かつ簡単にタンパク質をノックダウンすることができます。
このブログでは、Trim-Away1と呼ばれる、研究を加速させることができる抗体ベースのタンパク質ノックダウン手法をご紹介します。Trim-Awayに用いられるタンパク質分解方法は、事前に手を加えることなく、あらゆる内在性タンパク質に適合させることが可能であり、広く入手可能な抗体を用いて、様々な細胞タイプで実施することができます。
Trim-Awayの原理
Trim-Away技術は、細胞内に存在するタンパク質分解機構と抗ウイルス反応を利用し、標的特異的な抗体を用いることにより、手を加えていない自然な状態のタンパク質を数分でノックダウンすることができます。このプロセスにおける主要な構成因子である細胞内E3ユビキチンリガーゼのTRIM21は、抗体のFc領域に結合し、ユビキチン化され、結合している抗体やその特異的な標的とともにプロテアソームによって分解されます。既存の細胞プロセスを利用することにより、非特異的な不具合によるリスクの蓄積を最小化し、細胞の表現型を保つことができます。
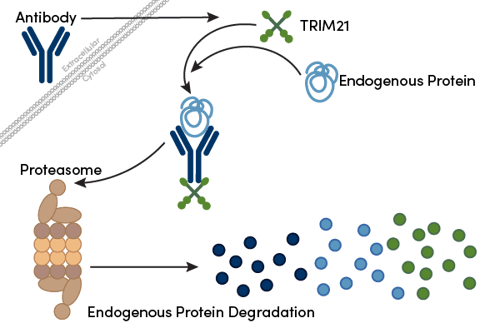 図1:Trim-Awayプロセスの概略図。抗体が細胞内に侵入すると、エピトープを介して標的と結合、さらにFc領域はTRIM21と結合します。その後、ユビキチン化が誘導され、抗体-標的-TRIM21複合体はプロテアソームによって分解されます。
図1:Trim-Awayプロセスの概略図。抗体が細胞内に侵入すると、エピトープを介して標的と結合、さらにFc領域はTRIM21と結合します。その後、ユビキチン化が誘導され、抗体-標的-TRIM21複合体はプロテアソームによって分解されます。
タンパク質のノックダウンにおけるTrim-Awayの利点
Trim-Away技術は、既存のタンパク質ノックダウン手法と比較していくつかの重要な利点があるため、研究室での手法の確立にほとんど時間がかからない、タンパク質ノックダウンに最適なツールです。特に、初代細胞や卵母細胞、増殖の遅い細胞などの、DNAのノックアウトまたはRNAベースのノックダウンが制限されるまたは機能しないモデルシステムでのタンパク質ノックダウンに役立ちます。
Trim-Awayの利点:
- 特異性が高い
- 翻訳後修飾の標的化が可能
- 遺伝子組換えは不要
- 簡単なセットアップ、追加の技術的専門知識は不要
- 検証が簡単
- 迅速な結果の取得
- TRIM21はハウスキーピング機能を持たないため、正常な細胞機能を維持
これらの利点から、以前は標的化できなかった長命タンパク質が、今ではノックダウン実験の主要な標的となっています。この新しい手法は、発生生物学や組織工学、免疫学、標的の探索において、すでにその潜在能力を誇示しており、ウシやネズミ、ヒトの胚における標的のノックダウンに成功しています2。この手法はさらに、総タンパク質量を変化させることなく、標的の特異的なPTM (翻訳後修飾) を激減させる能力も確認されています1。
Trim-Awayのセットアップは比較的単純であり、数分以内に標的タンパク質をノックダウンすることができるため、同じ日にこれらの細胞を用いた実験を行うことができます。実験を計画するときに注意すべき、いくつかのガイドラインをご紹介します。
抗体の選定基準
Trim-Awayを用いて、細胞内の標的タンパク質の特異的なノックダウンを実現するためには、目的の標的だけに結合する特異性の高い抗体が必要です。この手法を成功に導く最適な抗体は、免疫沈降用の検証済み抗体であり、これらの抗体は、Trim-Awayにおいて最も重要となる、自然な構造のタンパク質を認識することができます。使用する抗体は、細胞の生存率やシグナル伝達経路の活性化に干渉する恐れのあるグリセロールやBSA、アジ化物フリー組成である必要があります。
ほぼすべてのCell Signaling Technology (CST) モノクローナル抗体は、キャリアフリー組成、即出荷可能 、またはカスタム製品としてご提供可能です。CSTは、あらゆるアッセイにおける抗体の機能や特異性、感度を保証するために、Hallmarks of Antibody Validation™ (抗体検証における戦略) に従って、各抗体を厳密に検証しています。
適切なトランスフェクション法
トランスフェクションには、エレクトロポレーションとマイクロインジェクションの2つの手法が最も広く用いられています。胚にはマイクロインジェクションがより効果的であり、細胞株にはエレクトロポレーションが、よりよく機能します。これら以外にも、いくつかの研究室では古典的かつ化学的なトランスフェクション法を最適化し、機能させることを可能にしています3、4。
モデルシステムでのTRIM21量の測定
実験開始前に、モデルシステムにおけるTRIM21の発現量の確認を推奨します。The Human Protein AtlasやBioGPSなどの特異的な発現データベースを用いるか、または迅速なqPCR/ウェスタンブロット (WB) 実験を用いて確認することができます。
特定の、十分な量の内在性TRIM21を産生しない稀な細胞タイプを用いる場合は、抗体を含むトランスフェクション試薬に組換えTRIM21を加えて、一緒に細胞内に導入することができます。
最終結果の検証
標的タンパク質のノックダウンが成功したことを確認するため、ウェスタンブロッティングを行います。研究室でのTrim-Awayのセットアップ用に行う簡単な最初の実験には、抗GFP抗体を用いたGFP細胞株におけるGFPのノックダウンがお勧めです。分解プロセスを、蛍光顕微鏡でリアルタイムに観察することができます。
参考文献:
- Clift D, So C, McEwan WA, James LC, Schuh M. Acute and rapid degradation of endogenous proteins by Trim-Away. [published correction appears in Nat Protoc. 2018 Nov 30;:]. Nat Protoc. 2018;13(10):2149-2175. doi:10.1038/s41596-018-0028-3.
- Gerri C, McCarthy A, Alanis-Lobato G, et al. Initiation of a conserved trophectoderm program in human, cow and mouse embryos. Nature. 2020;587(7834):443-447. doi:10.1038/s41586-020-2759-x
- Clift D, McEwan WA, Labzin LI, et al. A Method for the Acute and Rapid Degradation of Endogenous Proteins. Cell. 2017;171(7). doi:10.1016/j.cell.2017.10.033
- Weir E, McLinden G, Alfandari D, Cousin H. Trim-Away mediated knock down uncovers a new function for Lbh during gastrulation of Xenopus laevis. Developmental Biology. 2021;470:74-83. doi:10.1016/j.ydbio.2020.10.014