多発性骨髄腫は形質細胞のがんであり、治療はできますが完治はできません。このブログでは多発性骨髄腫の治療法に変化をもたらした次世代プロテアソーム阻害剤や二重特異性モノクローナル抗体、抗体薬物複合体、CAR-T療法などの最新の進歩についてご紹介します。
多発性骨髄腫の治療法:新たな治療標的の探索
多発性骨髄腫はどのような病気でしょうか。多発性骨髄腫は、通常は骨髄に存在し感染に応答して抗体を産生する形質細胞のがんです。がん化した形質細胞が無制限に増殖することにより、骨髄内で赤血球や血小板、感染と戦う白血球などを産生する正常細胞の増殖が抑制されます。また、モノクローナル免疫グロブリンの異常な産生による腎機能障害や、骨あるいは軟組織における腫瘍の形成を引き起こします1-2。
多発性骨髄腫は、米国では比較的稀な疾患です。血液悪性腫瘍の中では2番目に多いがんですが、全てのがんに占める割合はわずか1%程度です。しかし、多発性骨髄腫は完治が難しく、依然として予後が不良な疾患です。疾患の管理に多数の治療法を必要とし、しばしば治療抵抗性の獲得や再発がみられます。そのため、単独またはその他の治療法と併用が可能な新しい治療法の開発が急務となっています。
プロテアソーム阻害剤:Bcl-2ファミリーを標的化
細胞死への抵抗性は、がん細胞の特性です。Bcl-2ファミリーに属する、アポトーシスを促進または抑制するタンパク質の活性化の微妙なバランスが、細胞が生き残るか細胞死するかを決定する原因の1つとなっています。多発性骨髄腫の新規診断例の多くで、Bcl-2ファミリーに属しアポトーシスを抑制するMcl-1の発現が増加しており、再発時にさらなる増加がみられることがあります。Bcl-2やBcl-xLも高発現していることから、タンパク質間の複雑な相互作用によって最終的にアポトーシスを回避する能力を獲得すると考えられています3。
そのため、いくつかのBcl-2ファミリー阻害剤は単独療法として、あるいはプロテアソーム阻害剤やPomalidomide、Lenalidomideなどの免疫調節薬、Dexamethasone、化学療法、放射線療法などの様々な多発性骨髄腫の治療法と併用できる治療法として有望視されています4。
過去20年、20Sプロテアソームのキモトリプシン様活性を可逆的に阻害するBortezomibなどのプロテアソーム阻害剤 (PI) が多発性骨髄腫の主な治療法となっています。ユビキチン/プロテアソーム系は異常な折りたたみ構造を持つタンパク質にタンパク質分解の目印としてユビキチン鎖を付加します。プロテアソームを阻害すると、多発性骨髄腫の細胞によって産生された異常な折りたたみ構造を持つ、または折りたたまれていないモノクローナル免疫グロブリンが小胞体 (ER) 内に蓄積し、この小胞体ストレスがアポトーシスを引き起こします。また、プロテアソームの阻害はIkBの発現増加を引き起こし、続いてアポトーシスを抑制するNF-kBタンパク質が阻害されます。Bortezomibは多発性骨髄腫患者の全生存期間の平均を上昇させましたが、この治療法の最も重大な副作用に末梢神経障害があります。さらに、時間の経過とともに治療抵抗性を獲得する患者もみられます。そのため、ユビキチン/プロテアソーム系の薬物動態的および薬力学的特性が異なる構成因子を標的とした新しいPIの開発が進んでいます。副作用を最小限に抑える方法の1つとして、ユビキチン/プロテアソーム系の上流において調節異常が見られる構成因子を標的とする方法が考えられています5。
モノクローナル抗体および抗体薬剤複合体
CD38やTNFRSF17/BCMA、CRACC/SLAMF7/CD319などの標的に対するモノクローナル抗体や抗体薬物複合体 (ADC) は、再発または難治性の多発性骨髄腫の追加療法に使用できます。例えば、TNFRSF17/BCMAを標的とするADCであるBelantamb-mafodotinが、2020年にFDAにより再発または難治性の多発性骨髄腫の治療薬として承認されています。また、T細胞のCD3と形質細胞のTNFRSF17/BCMAのように、複数のタンパク質を同時に標的とすることができる二重特異性モノクローナル抗体、特に二重特異性T細胞誘導抗体 (BiTE) は、初期の研究段階において有望視されています4 。
多発性骨髄腫は骨髄内の形質細胞に影響を与えます。そのため、高用量の化学療法により骨髄内の細胞を死滅させた後に幹細胞移植を行う治療法もあります。患者は、化学療法後に自己またはドナーの健全な幹細胞の移植を受けます。副作用としては、感染症にかかりやすくなることや血球の減少による出血、ドナーの幹細胞を移植した場合に生じる移植片対宿主病などがあります。しかし、多発性骨髄腫の患者の多くは年齢的に幹細胞移植は検討できず、最終的には再発するという課題も残っています6。
CAR-T細胞療法:TNFRSF17/BCMA、GPRC5D、CD38
最後に、CAR-T療法はすべてのがん、特に治療抵抗性を持つがんまたは再発性のがんに対して持続的な寛解もたらすという新たな治療法です。抗CD19CAR-T療法によりB細胞悪性腫瘍の長期寛解が得られているため、CAR-T療法は多発性骨髄腫の治療法として特に注目されています。CAR-Tの開発には、腫瘍以外に毒性を引き起こさない、効果的な標的抗原を選択することが最も重要です。多発性骨髄腫の標的としてTNFRSF17/BCMAやCRACC/SLAMF7/CD319、GPRC5D、CD38などが有望視されています。しかし、抗原エスケープの懸念は残るため二重特異性CAR-T細胞の開発など、CAR-T療法の選択肢を継続的に増やしていくことが重要です7-8。
多発性骨髄腫の治療法の選択肢は、過去20年間ほぼ変わっていません。しかし、T細胞療法などの新しい治療法の進歩により、多発性骨髄腫の完治に向けた治療法の開発が盛んに行われています。
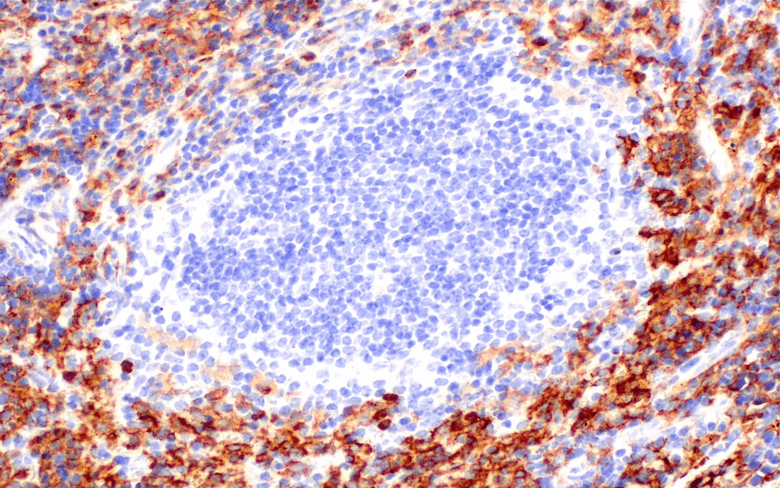
CRACC/SLAMF7/CD319 (E5C4M) Rabbit mAb #98611を用いたパラフィン包埋ヒト多発性骨髄腫を、免疫組織化学染色して解析しました。
参考文献
- American Cancer Society
- Multiple Myeloma Research Foundation
- Slomp A, Peperzak V. Role and Regulation of Pro-survival BCL-2 Proteins in Multiple Myeloma. Front Oncol. 2018 Nov 20;8:533.
- Bobin A, Liuu E, Moya N, Gruchet C, Sabirou F, Lévy A, Gardeney H, Nsiala L, Cailly L, Guidez S, Tomowiak C, Systchenko T, Javaugue V, Durand G, Leleu X, Puyade M. Multiple Myeloma: An Overview of the Current and Novel Therapeutic Approaches in 2020. Cancers (Basel). 2020 Oct 8;12(10):2885.
- Lub S, Maes K, Menu E, De Bruyne E, Vanderkerken K, Van Valckenborgh E. Novel strategies to target the ubiquitin proteasome system in multiple myeloma. Oncotarget. 2016 Feb 9;7(6):6521-37.
- Al Hamed R, Bazarbachi AH, Malard F, Harousseau JL, Mohty M. Current status of autologous stem cell transplantation for multiple myeloma. Blood Cancer J. 2019 Apr 8;9(4):44.
- Mikkilineni L, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for multiple myeloma. Blood. 2017 Dec 14;130(24):2594-2602.
- Rodríguez-Lobato LG, Ganzetti M, Fernández de Larrea C, Hudecek M, Einsele H, Danhof S. CAR T-Cells in Multiple Myeloma: State of the Art and Future Directions. Front Oncol. 2020 Jul 28;10:1243.