ここ50年間、細胞死に貢献するプロセスが実験により実証されてきました。初期の研究では、細胞死は形態的特徴からアポトーシスとネクローシスへ分類されていましたが、その後アポトーシスに貢献する「プログラムされた」細胞経路に関し、新たな発見が続々となされました。
研究が進むにつれて、アポトーシスはCaspase-3、Bcl-2、Fasといったタンパク質に厳密に制御される「プログラムされた」細胞死であることが分かってきました。細胞死は単純に見えますが、細胞死には当初予想されていたよりはるかに多くの細胞内シグナル伝達経路が関わっています。
制御されたネクローシス様の細胞死:ネクロプトーシスとパイロトーシス
ここ数年の研究で、「制御された」ネクローシス様の細胞死が、生理病理学的に多くの役割を持つことが明らかになり、医療分野への応用が期待されるようになりました。細胞の膨張や細胞膜への孔の形成、細胞膜の崩壊といった、形態学的にネクローシスの特徴を持つ「制御された」細胞死の代表として、ネクロプトーシスとパイロトーシスの2つが知られています。これらのプロセスでは、細胞膜の崩壊によってHMGB1や炎症性サイトカインであるインターロイキン-1β (IL-1β)、IL-18といったダメージ関連分子パターン (DAMPs) と呼ばれる分子群が細胞から放出され、炎症反応が惹起されます。
ネクロプトーシス
ネクロプトーシスはアポトーシスが抑制された環境において活性化される細胞防御経路であり、MLKL偽キナーゼをリン酸化するRIPK3の活性化によって引き起こされます。MLKLは、Ser358 (マウスではSer345) がリン酸化されると多量体化し、孔形成複合体 (pore-forming complex) を形成します。MLKL poreはカチオンチャネルを形成し、細胞膜の崩壊とDAMPsの分泌を、さらに促進します。RIPK3は、RHIM (RIP homotypic interaction motif) ドメインを介してRIPK1、TRIF、ZBP1/DAIと相互作用することでSer227 (マウスではThr231/Ser232) がリン酸化され、活性化します。TNFファミリーによるネクロプトーシスの誘導では、RIPK1の自己リン酸化 (Ser166など) がこれらのシグナル伝達に必要であることが分かっており、RIPK1の直接的な阻害剤であるNecrostatin (Nec-1, Nec-1s) はこの経路を阻害します。
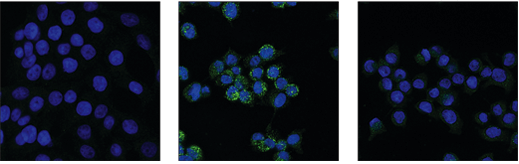 未処理コントロール (左)、Z-VAD 20 µMで30分間前処理した後SM-164 100 nMおよびHuman Tumor Necrosis Factor-α (hTNF-α) # 20 ng/mLで6時間処理 (中央)、Z-VADで前処理した後SM-164、hTNF-αおよびプロセシング済みホスファターゼで処理 (右) したHT-29細胞を、Phospho-RIPK3 (Ser227) (D6W2T) Rabbit mAb #93654 (緑) を用いて免疫蛍光染色し、蛍光顕微鏡で解析しました。
未処理コントロール (左)、Z-VAD 20 µMで30分間前処理した後SM-164 100 nMおよびHuman Tumor Necrosis Factor-α (hTNF-α) # 20 ng/mLで6時間処理 (中央)、Z-VADで前処理した後SM-164、hTNF-αおよびプロセシング済みホスファターゼで処理 (右) したHT-29細胞を、Phospho-RIPK3 (Ser227) (D6W2T) Rabbit mAb #93654 (緑) を用いて免疫蛍光染色し、蛍光顕微鏡で解析しました。
一方、DNAウイルスによるZBP1/DAIの活性化や、TRIFによるTLR (Toll-like receptor) のリクルートといった自然免疫応答によってもRIPK3の活性化が起こります。これは、病原体がアポトーシスを阻害した場合に、代替となる細胞死誘導機構としてネクロプトーシスが活性化されると捉えることができます。RIPK1とRIPK3はCaspase-8の媒介による切断を受けることが知られており、アポトーシスはネクロプトーシスを抑制すると考えられます。ネクロプトーシスによって放出されるDAMPsはパイロトーシスや炎症反応を引き起こします。
パイロトーシス
パイロトーシスとネクロプトーシスにはいくつか類似点がありますが、ネクロプトーシスが、アポトーシスが阻害された場合に細胞死を実行する、第二の機構だと考えられているのに対し、パイロトーシスは一般に、感染性生物に対する第一の反応だと考えられています。パイロトーシスは、微生物病原体に発現する病原体関連分子パターン (PAMPs) や細胞由来のDAMPsによって、単核球、マクロファージ、樹状細胞といった自然免疫細胞で起こります。パイロトーシスの誘導には、Caspase-1が活性化され、それに続くIL-1βやIL-18などの炎症性サイトカインの切断と活性化が必要です。さらに、Caspase-1は孔形成タンパク質Gasdermin D (GSDMD) を切断します。
Gasdermin Dは切断されるとN末端フラングメントが多量体化し、MLKLと同様に (MLKLより大きな) 孔を形成し、炎症を引き起こすDAMPsやサイトカインが分泌されるようになります。このとき、Caspase-1は様々なインフラマソーム複合体形成 (典型的には、細胞質パターン認識受容体 [PPR;ヌクレオチド結合ドメインおよびロイシンリッチリピート (NLR) またはAIM2-like receptor (ALR) ファミリーメンバー]、アダプタータンパク質 (ASC/TMS1) および、前駆体Caspase-1からなる) を介して活性化されます。個々のインフラマソームは別個のDAMPsや PAMPsを認識し、パイロトーシスを誘導します。NLRのうち、最も解析が進んでいるNLRP3の経路では、パイロトーシスは2つの段階を経て起こることが分かっています。第一段階では、NF-κBが活性化され、インフラマソームの構成成分であるNLRP3や前駆体IL-1β、前駆体IL-18の発現が誘導されます。第二段階ではCaspase-1が活性化され、Gasdermin Dや炎症性サイトカインが、切断されることで活性化します。
ネクローシスシグナル伝達経路と疾患
制御されたネクローシスのシグナル伝達経路の研究は、主に感染症に関連づけて行われてきましたが、この他にも、神経変性疾患、自己免疫疾患、がん、代謝性疾患、循環器疾患、肝臓や膵臓、腎臓、腸などの各種臓器における炎症や慢性炎症疾患など、広範囲の病理学的意義を持つことが明らかになりつつあります。このため、ネクロプトーシスやパイロトーシスを制御する経路は、重要なバイオマーカーや分子医療の標的を含む可能性を秘めており、医療分野への応用が期待されています。
現在、関節炎やその他の炎症性疾患の治療のため、IL-1βおよびその受容体を標的とした分子標的医療が実用化されています。これらは普遍的に免疫を抑制し得るという問題点もあります。NLRや炎症性Caspaseなどのインフラマソームの阻害は、より標的を絞ったアプローチであると考えることができ、より広範囲に適用可能な治療薬の開発に繋がる可能性があります。RIPK1、RIPK3、MLKLを直接標的としたネクロプトーシス阻害剤の開発も進んでおり、神経変性疾患および炎症性疾患に効果が見込まれるRIPK1阻害剤は、既に臨床試験が実施されています。
これらの経路の研究は、多くの疾患の治療法の開発や病態理解に大きく貢献するものと期待されています。
様々なタイプの細胞死に関与するメカニズムや形態、主要なタンパク質についての詳細は、研究者向けガイドの細胞死のメカニズムをご覧ください。
ネクロプトーシスおよびパイロトーシスのAntibody Samplerキット
参考文献:
- Shan B, Pan H, Najafov A, Yuan J. Necroptosis in development and diseases. Genes Dev. 2018;32(5-6):327-340. doi:10.1101/gad.312561.118
- Frank D, Vince JE. Pyroptosis versus necroptosis: similarities, differences, and crosstalk. Cell Death Differ. 2019;26(1):99-114. doi:10.1038/s41418-018-0212-6
- Shi J, Gao W, Shao F. Pyroptosis: Gasdermin-Mediated Programmed Necrotic Cell Death. Trends Biochem Sci. 2017;42(4):245-254. doi:10.1016/j.tibs.2016.10.004
- Weinlich R, Oberst A, Beere HM, Green DR. Necroptosis in development, inflammation and disease. Nat Rev Mol Cell Biol. 2017;18(2):127-136. doi:10.1038/nrm.2016.149
- Zakeri Z, Lockshin RA. Cell death: history and future. Adv Exp Med Biol. 2008;615:1-11. doi:10.1007/978-1-4020-6554-5_1