ウイルス感染時の細胞死の制御は、ウイルスと宿主の生存のバランスを保つための重要なファクターです。このシリーズでは、ウイルスやウイルス由来のタンパク質への細胞応答に関与するパスウェイを概説します。コロナウイルスのSARS-CoVや SARS-CoV-2の感染は、肺胞や気管支上皮細胞の広範な損傷を伴う重篤な肺の障害や、肺外の損傷の原因となります。
ウイルス (SARS-CoV-2) 感染における小胞体 (ER) ストレスとオートファジーの役割については、こちらのブログをご覧ください。
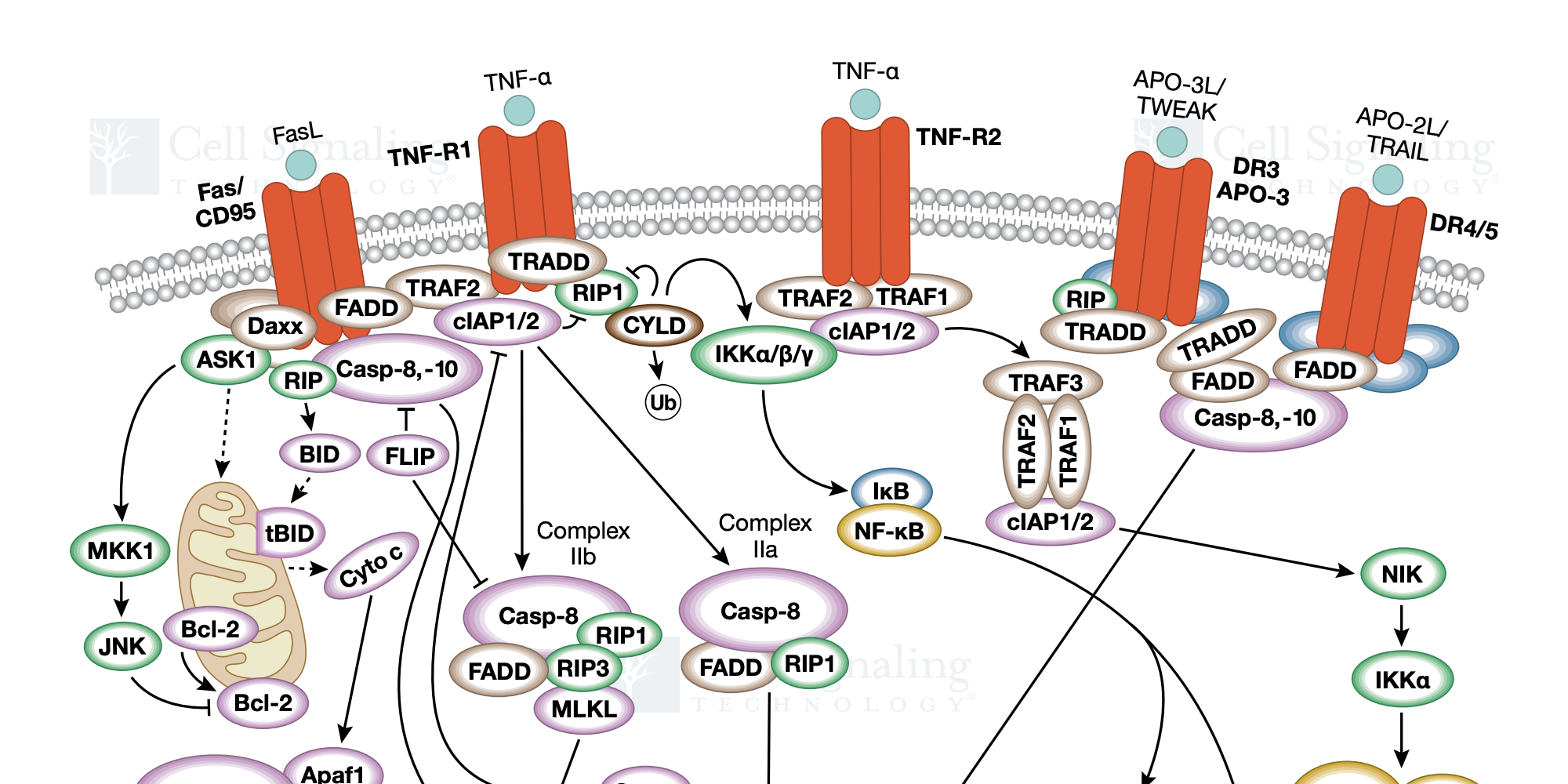
ウイルス感染への応答において、細胞死は炎症性サイトカイン・ストームを介し、感染細胞と隣接細胞の両方に起こります。プログラム細胞死には、形態学的に異なるプロセスを経るアポトーシスとネクローシスがあり、これらが高度にクロストークしています。アポトーシスは、いくつかのコロナウイルスに由来のタンパク質や、小胞体ストレス応答 (UPR) によって誘導されます。これは、数十年にわたって研究されている厳密に制御されたプロセスで、一般にCaspase-3の活性化によって引き起こされます。Caspase-3は酵素前駆体として産生され、上流の調節カスパーゼによって切断されることで活性化します。活性化されたCaspase-3はPARPなどのタンパク質を切断し、細胞死に関与します。内因性アポトーシスは、Bcl-2ファミリーのメンバーによって制御されています。Bcl-2ファミリーはミトコンドリア外膜透過性 (MOMP) を調節し、ミトコンドリアからのシトクロムcの放出と、その下流のCaspase-9、Caspase-3の活性化を制御します。Bcl-2ファミリーは多くの関連タンパク質で構成され、アポトーシスを促進するもの (Bax、Bak)、アポトーシスを抑制するもの (Bcl-2、Bcl-xL、Mcl-1、A1/Bfl-1、Bcl-w) が含まれます。また、Bcl-2ファミリーには「BH-3 only」タンパク質 (Bim、Bid、Bad、Bik、Puma、Noxa、Hrk、BMF) が含まれ、これらは高度な制御を受け、Bax/Bakの活性化を促進します。SARSコロナウイルスは、Bcl-2ファミリーを直接制御してアポトーシスを誘導する機構を獲得しています。例えば、SARS-CoVタンパク質7aは、Bcl-xLへの結合を介してアポトーシスを誘導します。また、SARS-CoVとSARS-CoV-2のエンベロープタンパク質 (E) は、アポトーシスの誘導に関与する保存されたBH3ドメインを持ち、これがウイルス毒性に関与しています。アポトーシスは外因性経路によっても引き起こされます。この経路では、TNFRスーパーファミリーに属するデスレセプターがCaspase-8に会合してDISC (death-inducing signaling complex) を形成し、下流のCaspase-3の活性化を誘導します。アポトーシスは、TUNEL (Terminal deoxynucleotidyl transferase dUTP nick end labeling) 法、Caspase-3などのカスパーゼの活性化、Bcl-2ファミリーのメンバーの発現、シトクロムcの放出、Annexin Vの染色など、確立された一連のアッセイでモニタリングすることができます。
近年、ネクローシス性細胞死は炎症反応の一環として生じ、組織の損傷や線維症に関与することが分かってきました。細胞の膨張、細胞膜への小孔の形成といったネクローシス様の形態学的特徴を持ち、HMGB1や炎症性サイトカインなどのダメージ関連分子パターン (DAMPs) を放出する細胞死の代表例としてネクロプトーシスとパイロトーシスの2つが知られています。ネクロプトーシスはアポトーシスが抑制された環境において活性化される細胞防御経路です。実際に多くのウイルスがアポトーシスを抑制する機構を備えており、そのためにこの細胞死機構が活性化されます。ネクロプトーシスは、MLKLのSer358 (マウスではSer345) をリン酸化するRIPK3の活性化によって引き起こされます。MLKLはリン酸化されると多量体化し、小孔形成複合体 (pore-forming complex) を形成します。RIPK3は、RHIM (RIP homotypic interaction motif) ドメインを介してRIPK1、TRIF、ZBP1と相互作用することでSer227 (マウスではThr231/Ser232) がリン酸化され、活性化します。RIPK1を介した古典的なネクロプトーシス経路には、RIPK1のSer166の自己リン酸化が重要な役割をもち、これはNecrostatinで阻害することができます。一方、TLR (Toll-like receptor) によるTRIF動員や、DNAウイルスによるZBP1の活性化といった自然免疫応答によってもRIPK3の活性化が起こります。アポトーシスは、Caspase-8によるRIPK1とRIPK3の切断を介してネクロプトーシスを抑制します。実際に、神経侵襲性コロナウイルスOC43によって、ニューロン細胞のネクロプトーシスが観察されています。SARS-CoVのアクセサリータンパク質3aはRIPK3と相互作用し、ネクローシス性の細胞死を促進します。
パイロトーシスは、もう1つのネクローシス性細胞死経路で、Gasderminファミリーによる小孔の形成が特徴です。パイロトーシスはTLRの活性化やDAMPsによって自然免疫細胞で起こります。古典的なこの経路では、Caspase-1によるGasdermin Dの切断が起こり、Gasdermin DのN-末端断片が膜に小孔を形成します。Caspase-1は、IL-1bやIL-18などの炎症性サイトカインも切断して活性化し、これらはGasdermin Dによって形成された膜孔を通過して細胞外に分泌されます。Caspase-1は、インフラマソームと呼ばれる、病原体を感知する複合体を介して活性化されます。NLRP3、ASC、Caspase-1を含むインフラマソーム複合体は、微生物病原体、カリウムの流出、リソソーム傷害物質を含む2段階のプロセスの一部として活性化されます。重要なことに、Caspase-3はGasdermin Dの別のN-末端部位を切断し、小孔形成を不活性化することができます。上記のように、SARSの3aはネクロプトーシスを活性化しますが、直接的あるいはNLRP3を介してCaspase-1を活性化することもできます。SARS-CoVがNLRP3インフラマソーム活性化とパイロトーシスを誘導し、血清IL-1β濃度の増加を促進することが分かっています。
ウイルス感染への応答にはアポトーシスやネクローシス、パイロトーシス経路の活性化が含まれており、これらがウイルス毒性や宿主組織への損傷に重要な役割を担います。これらの経路は高度にクロストークしていますが、これらの経路を解明するための新しい試薬の出現が、より理解に役立つものと期待されています。これらの応答を制御する、新規の治療薬の役割が非常に注目されています。
詳細はこちら:
-
このブログ・シリーズのパート2もご覧ください:ウイルス感染におけるオートファジーと小胞体ストレスの役割
-
細胞死のメカニズム関するCSTのブログ・シリーズをご覧ください:
参考文献
-
Fung TS, Liu DX. コロナウイルス感染、ERストレス、アポトーシスと自然免疫。Frontiers in Microbiology2014 Jun 17;5:296. doi: 10.3389/fmicb.2014.00296. PMID: 24987391; PMCID: PMC4060729.
-
Tan YX, Tan TH, Lee MJ, Tham PY, Gunalan V, Druce J, Birch C, Catton M, Fu NY, Yu VC, Tan YJ. Induction of apoptosis by the severe acute respiratory syndrome coronavirus 7a protein is dependent on its interaction with the Bcl-XL protein. J Virol. 2007 Jun;81(12):6346-55. doi: 10.1128/JVI.00090-07. Epub 2007 Apr 11. PMID: 17428862; PMCID: PMC1900074.
-
Yue Y, Nabar NR, Shi CS, Kamenyeva O, Xiao X, Hwang IY, Wang M, Kehrl JH. SARS-Coronavirus Open Reading Frame-3a drives multimodal necrotic cell death. Cell Death & Disease2018 Sep 5;9(9):904. doi: 10.1038/s41419-018-0917-y. PMID: 30185776; PMCID: PMC6125346.
-
Siu KL, Yuen KS, Castaño-Rodriguez C, Ye ZW, Yeung ML, Fung SY, Yuan S, Chan CP, Yuen KY, Enjuanes L, Jin DY. Severe acute respiratory syndrome coronavirus ORF3a protein activates the NLRP3 inflammasome by promoting TRAF3-dependent ubiquitination of ASC. FASEB J. 2019 Aug;33(8):8865-8877. doi: 10.1096/fj.201802418R. Epub 2019 Apr 29. PMID: 31034780; PMCID: PMC6662968.
-
Meessen-Pinard M, Le Coupanec A, Desforges M, Talbot PJ. Pivotal Role of Receptor-Interacting Protein Kinase 1 and Mixed Lineage Kinase Domain-Like in Neuronal Cell Death Induced by the Human Neuroinvasive Coronavirus OC43. J Virol. 2016 Dec 16;91(1):e01513-16. doi: 10.1128/JVI.01513-16. PMID: 27795420; PMCID: PMC5165216.
-
Miller K, McGrath ME, Hu Z, Ariannejad S, Weston S, Frieman M, Jackson WT. Coronavirus interactions with the cellular autophagy machinery. オートファジー。2020 Sep 23:1-9. doi: 10.1080/15548627.2020.1817280. 論文は印刷前に電子的に出版されます。PMID: 32964796.