抗体がどのように作られるのか、また、様々なタイプの抗体の長所と短所を理解することは、実験のデザインや再現性の高いデータを得るために大変重要です。抗体の必須知識Part 1シリーズでは、抗体がどのように作られるか、どのような構造をしておりどのように機能するか、そして様々な種類の抗体の長所と短所について解説しました。Part2では、抗体が驚くほど機能的な多様性を獲得する生物学的メカニズムを解説し、さらに抗体を分類する様々な方法をご紹介します。
目次
抗体の多様性と分類を理解する
ご存知のように、抗体はB細胞と呼ばれる特定の免疫細胞が適応免疫応答において産生する複合タンパク質です。免疫系には動物が一生の間に遭遇し得る何千もの異なる病原体を認識する能力が必要になります。しかし、ほぼ無限の抗原が存在する中、B細胞は全ての潜在的な標的に対する抗体をどのように生み出すのでしょうか?この疑問を解決するため、基本的なB細胞の発生と、これらの免疫学的な役割を簡単に説明します。
抗体の多様性はどのように生まれるか?
血中を循環するすべてのB細胞は、骨髄と脾臓で成熟した後、膜結合型免疫グロブリン (抗体) Igα/Igβ (CD79a/CD79b) ヘテロ二量体により構成される特有のB細胞受容体 (BCR) を発現します。BCRが抗原に遭遇して認識すると、B細胞は抗原を取り込んでプロセシングを行います。抗原断片は、主要組織適合遺伝子複合体 (MHC) クラスII分子と結合して複合体を形成し、この断片-MHCクラスII複合体は、最終的にB細胞表面に提示されます。ヘルパーT (Th) 細胞上の受容体がこの複合体を認識して結合すると、Th 細胞は活性化し、B細胞の活性化および増殖、形質細胞への分化を誘導するサイトカインを産生します。これにより、病原体を殺すために免疫細胞がリクルートされたり、免疫系による抗原の排除を促進する抗体を分泌する形質細胞の、急速な同一クローンの増殖が引き起こされます。多くの形質細胞は短命ですが、一部は生き残り、同一抗原に曝露された際に保護的な機能を発揮するメモリーB細胞となります。
それぞれのB細胞クローンが、細胞表面に異なる抗体を発現することにより、適応免疫の効果が得られるのです。では、その仕組みを詳しくみてみましょう。
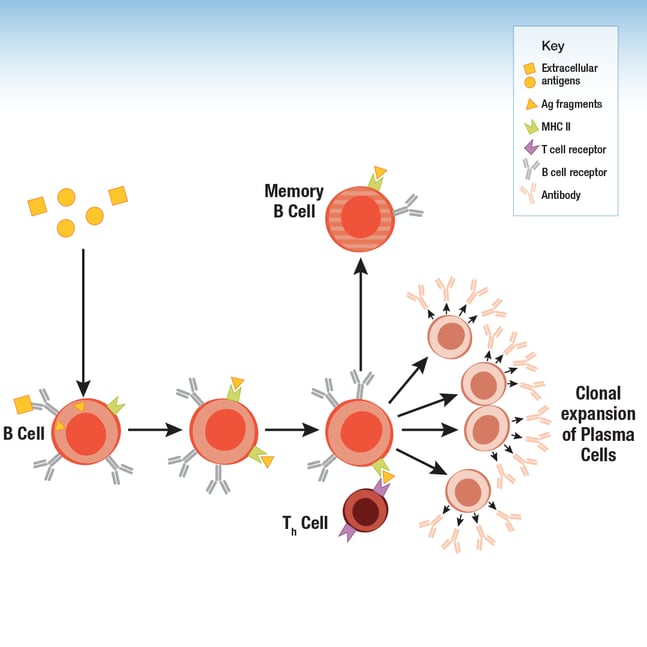 図1:B細胞はMHC II複合体を介して細胞表面に抗原断片を提示します。免疫応答においてTh細胞はB細胞のクローン拡大を誘導し、抗体産生の増加を促進します。
図1:B細胞はMHC II複合体を介して細胞表面に抗原断片を提示します。免疫応答においてTh細胞はB細胞のクローン拡大を誘導し、抗体産生の増加を促進します。
B細胞の発生初期 (成熟前) に、抗体の重鎖と軽鎖をコードする遺伝子のDNA再編成などが起こり、B細胞表面の抗体の多様性が生み出されます。これにはV(D)J組換え、接合部の多様性、体細胞超変異の3つの主要なメカニズムが重要になります (図2)。
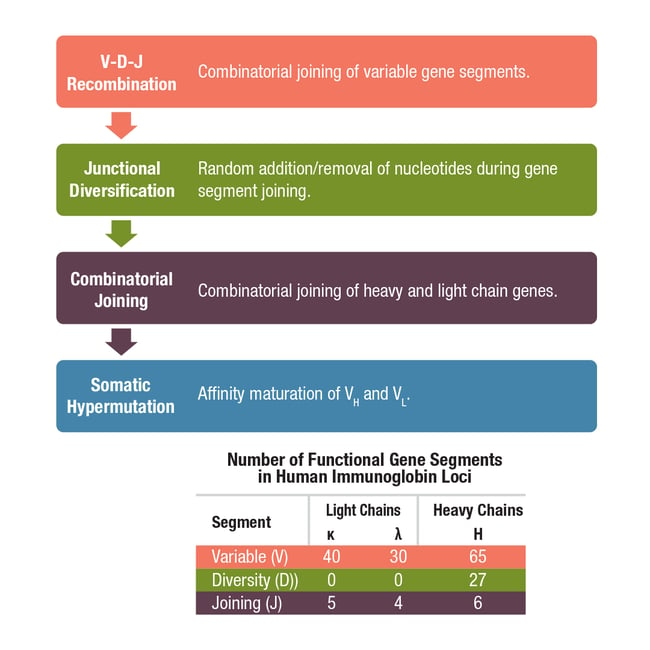
図2:抗体の多様性に関与するメカニズム
まず、B細胞の発生過程にみられるvariable遺伝子、diversity遺伝子、joining遺伝子といった異なる遺伝子領域のスプライシングにより生じるV(D)J組換えについて考えましょう。ひとつなぎの鎖遺伝子がスプライスされて、1つのvariable (V) 遺伝子断片、1つのdiversity (D) 遺伝子断片、および1つのjoining (J) 遺伝子断片からなる抗体の重鎖が生じますが、軽鎖はV (Kappa/κまたはlambda/λ) 遺伝子断片およびJ遺伝子断片からなり、D遺伝子断片を含みません。V、D、J遺伝子断片の数は非常に多く (図2)、さらにリンパ球特異的なリコンビナーゼ複合体によってこれらの断片のランダムな組換えが起こることで、理論上何百万もの遺伝子構成が可能になります。また、V(D)J酵素複合体がこれらを結合する際にV領域をコードする配列の末端にランダムなヌクレオチドの欠失や付加が起こります。この接合部の多様性により全体の多様性はさらに増大します。
V(D)J組換えと接合部の多様性が形成された後、重鎖と軽鎖の遺伝子配列が正しい順序で配置され、機能的な抗体ポリペプチドが産生されます。しかし、この組換えの起こった遺伝子はさらに、体細胞超変異と呼ばれる第3段階目の多様化を受けます。体細胞超変異はB細胞の活性化の後に起こる現象で、重鎖と軽鎖の可変領域に点変異が蓄積します。これらの変異の割合は他の遺伝子の変異 (バックグラウンド) の割合より約100万倍高く、これによって抗体プールの多様性はさらに増大します。この結果、適応免疫応答が進むにつれてより親和性の高い抗体が得られるようになります。このプロセスは親和性成熟と呼ばれます。このような多様化のメカニズムによって、何十億もの固有の抗原に反応する抗体が産生され、あらゆる非自己抗原に対する免疫応答が可能になります。
参考:Janeway CA Jr, Travers P, Walport M, et al.The generation of diversity in immunoglobulins. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
抗体はどのように分類されるか?
ここまでは抗体の多様性が生み出されるメカニズムを説明してきましたが、次に抗体の分類を説明します。抗体は一般的に次に挙げるような様々な方法で分類されます。
- 標的への反応性
- 種交差性
- 抗体作製に用いる免疫動物種 (宿主)
- ポリクローナル抗体とモノクローナル抗体
- 研究用、診断用、医療用
- リコンビナント抗体と非リコンビナント抗体
この抗体の分類方法を、以下で詳しく解説します。
標的への反応性
実験に用いる抗体の選択を始める場合に、最初に思案するのは標的への反応性ではないでしょうか。特性がよく調べられ、特異性と選択性の両方に優れた抗体は、標的となる生体分子 (多くの場合はタンパク質) に反応して結合し、標的以外の分子とは反応しません。期待される標的への反応性を示すため、抗体製品の名称には通常、標的タンパク質の名称が含まれています。
多くの標的の場合、標的に反応する抗体は複数入手可能です。これらは同一標的の異なるエピトープを認識し、性能の特性はわずかに異なる可能性があります。このため、実験をデザインする場合、検証データを掘り下げてそれぞれの詳しい情報を得ることが重要です。
選択性が低くても特異性の高い抗体は、用法が適切であれば有用なツールになることもあります。このような例として、Cadherinファミリーの複数のメンバーに保存された抗原に反応するPan-Cadherin Antibodyがあります。汎特異性 (pan-specific) の抗体を用いてスクリーニング実験を行った後、このファミリー内の個々の標的に的を絞るためにより選択性の高い抗体を使用することができます。
多くのタンパク質はリン酸化、切断、メチル化、ユビキチン化、アセチル化といった翻訳後修飾 (PTM: Post-Translational Modification) を受け、これらが正常な、あるいは病理的な生物学的プロセスにおける細胞内シグナル伝達の活性化を担うことがあります。PTMはタンパク質のシグナル伝達以外の機能の活性化や不活性化に寄与することもあります。修飾特異的抗体は、その名が示すように、特定のアミノ酸に特定の修飾をもつ標的のみに反応し、修飾を受けていない標的には反応しません。修飾特異的な抗体を用いた実験を計画する場合には、標的タンパク質の総発現量 (修飾を受けた標的+修飾を受けていない標的) を認識する別の抗体を用いた実験も同時に計画すると便利です。これによって、修飾特異的抗体によって得られたデータの変化が、標的タンパク質の発現量そのものの変化によるものではないことを確認できます (図3)。
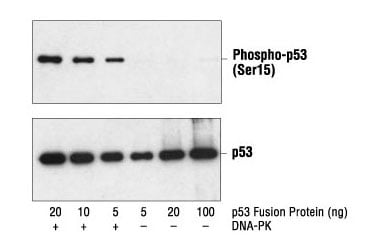 図3未処理、またはDNA-PKによるリン酸化を受けたp53融合タンパク質を、Phospho-p53 (Ser15) Antibody #9284 (上) および p53 Antibody #9282 (下) を用いてウェスタンブロットで解析しました。
図3未処理、またはDNA-PKによるリン酸化を受けたp53融合タンパク質を、Phospho-p53 (Ser15) Antibody #9284 (上) および p53 Antibody #9282 (下) を用いてウェスタンブロットで解析しました。
点突然変異とその他の種類の変異に対する特異性と共に開発された抗体もあります。点突然変異特異的抗体は、特異的なアミノ酸の置換を有する標的タンパク質のみと反応します。あまり一般的ではありませんが、SS18-SSX融合タンパク質のような、in-frame融合変異の結果として生み出されるタンパク質のみを認識する、融合特異的抗体もあります。標的タンパク質のN末端を認識する抗体とC末端を認識する抗体を用いた実験をデザインすることで、切り取られたタンパク質の欠失変異を調べることができます。臨床診断ツールとして、がんなどの疾患プロセスに関与する変異を認識する抗体が開発されることもあります (下記参照)。
種交差性
種交差性とは標的タンパク質の生物種を指します。後記する抗体の宿主の生物種と混同しないようにご注意ください。例えば、マウスで発現する多くのタンパク質には、他の哺乳動物種で発現するホモログ (進化的に関連するタンパク質) が存在しします。マウス抗原に対して作製した抗体は、マウスホモログのみに反応し、同じタンパク質のヒトやラットのホモログには反応しない場合があります。一方で複数の生物種のホモログに反応する抗体もあります。抗体の種交差性の範囲の広さは、主にエピトープ配列の保存性の度合いに影響されます。つまり、高度に保存されたエピトープに対する抗体は、複数の生物種で検証を行う価値がある抗体になる可能性が高くなります。
実験モデルに適した種交差性をもつ抗体を選択すると良いでしょう。つまり、マウス細胞株を用いる実験ではマウス交差性のある抗体、ヒト細胞株を用いる実験ではヒト交差性のある抗体を探します。マウス細胞株でヒトタンパク質を発現させるような外来性遺伝子発現モデルの場合は、ヒト交差性がありかつマウス交差性が無い抗体が必要なこともありますが、マウスホモログをノックアウトしたり、外来性タンパク質にエピトープタグを遺伝子工学的に付加する実験をデザインすることもできます。
抗体の宿主種
抗体は、産生した生物種によって分類することもできます。特にモノクローナル抗体の場合、ラビット、マウス、ラットが研究用抗体の作製に最もよく使用される宿主種です。この理由の1つに、これらの生物種は飼育が比較的容易であることが挙げられます。ポリクローナル抗体の場合、マウスやラットで作製することもありますが、大量の血清を採取し易いラビット、ヤギ、ロバ、ヒツジなどより大型な動物で作製するのが一般的です。
免疫アッセイをマルチプレックス化 (多重解析) する場合、一般的には別々の標的に対して宿主生物種の異なる一次抗体を利用し、別々の蛍光色素で標識した二次抗体を組み合わせます。この実験デザインでは、一次抗体の定常領域の生物種特異性に基づいて、それぞれの二次抗体が一次抗体のいずれか1つのみを認識します。
例えば「ヤギ抗マウスIgG」二次抗体は、ヤギを宿主として産生されたもので、マウス宿主で産生された一次抗体を認識します。蛍光色素で標識することで、顕微鏡やフローサイトメーターを利用してそれぞれの標的の検出や読み取りが可能になります。しかし、宿主種やアイソタイプなどの重要な詳細を把握することは不可欠であり、一次抗体、二次抗体のすべてが使用目的に応じて十分に検証されていなければなりません。これを怠ると、誤った解釈の原因となるような結果が得られることになります。
抗体のアイソタイプとサブクラス
哺乳動物では、抗体に含まれる重鎖に応じて5つの主要なアイソタイプ (またはクラス) に分類されます。抗体の重鎖にはγ、α、δ、ε、μがあり、それぞれのアイソタイプはIgG、IgA、IgD、IgE、IgEと呼ばれています。それぞれの重鎖は定常ドメインの数や配列、ヒンジ領域の構造が異なり、生物種によっては各アイソタイプをさらにサブタイプに分けることができます (図4)。
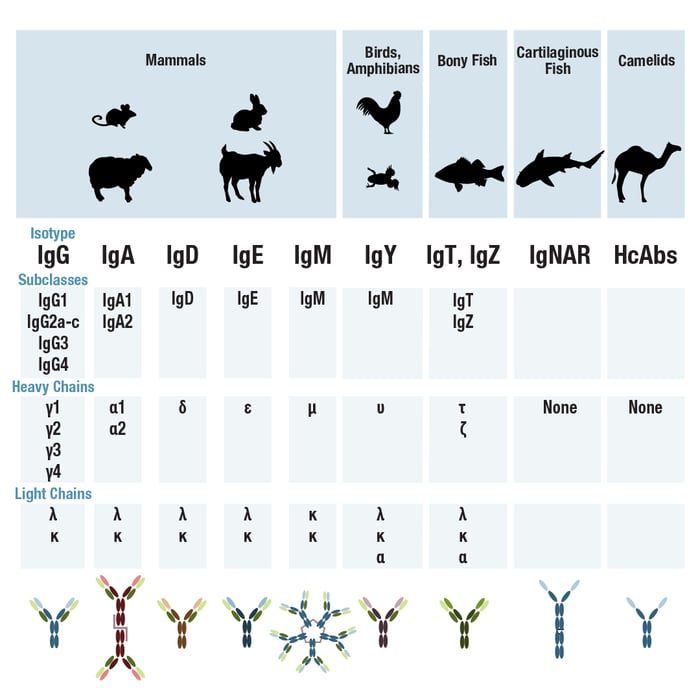
例えば、ヒトのIgGアイソタイプはIgG1からIgG4までの4つのサブタイプ (またはサブクラス) に分類されますが、マウスIgGには5つの異なるサブタイプが存在します。ラビットは、1つのアイソタイプしか持ちません ( IgG. )。標的に対する特異性が異なる場合でも、同じサブタイプの抗体の定常ドメインは同一の配列になります。そのため、ペプシン消化で得られるFc断片は同じです。また、同じ抗原に対して2つ以上の生物種の抗体、2つ以上のアイソタイプやサブタイプの抗体を作製することも可能です。
同じ実験にアイソタイプやサブタイプの異なる抗体を組み合わせて利用することで、マルチプレックス (多重解析) 実験における解析対象を増やし、より複雑な解析をすることができます。例えば、マウスIgG1とIgG2の一次抗体に対して、IgG1とIgG2を区別できるサブタイプ特異的な二次抗体を組み合わせることができます。
また、B細胞の成熟過程で選択された軽鎖の遺伝子座に基づき、すべての哺乳動物の抗体軽鎖はκとλのいずれかに分類できる点も重要です。軽鎖のタイプを利用して、さらにマルチプレックス化することができます。非哺乳動物種には、哺乳動物種とは異なる抗体のアイソタイプがあることにも注意が必要です。例えば、鳥類はIgY抗体を、ニジマスなどの硬骨魚類はIgT抗体を産生します。繰り返しになりますが、アイソタイプの異なる抗体を検出する場合には、十分に検証された適切な二次抗体を入手することが重要です。
最後に、抗体のアイソタイプごとの大きな違いに、結合価、つまり結合可能な部位の数があります。IgG、IgD、IgEが2価であるのに対し、IgAは4価、IgMは10価です。抗体の必須知識Part 1と図5に示したように、結合価が大きいほど免疫グロブリン分子はより多くの抗原を結合することができ、親和性も高くなります。
クローン性:ポリクローナル抗体とモノクローナル抗体
抗体をポリクローナル抗体とモノクローナル抗体に分類することもできますが、これらの主な違いは抗体を産生するB細胞です。ポリクローナル抗体は不均一な (混合された) B細胞集団から得られる抗体で、ポリクローナル抗体のチューブには、実際には多くの異なる抗体が含まれています。選択性の高いポリクローナル抗体の場合は、この混合物中の抗体は同じタンパク質上の複数のエピトープに結合し、他のエピトープには結合しません (図5)。
一方、モノクローナル抗体は同一のB細胞が産生した抗体で、精製されたモノクローナル抗体のチューブには同じ抗体の大量のコピーが含まれ、単一のエピトープに結合します。結論としては、利用可能なモノクローナル抗体がある場合、ポリクローナル抗体を利用するより一貫した結果が得られやすくなりますが、このトピックの詳細は抗体の必須知識Part 4で取り扱います。
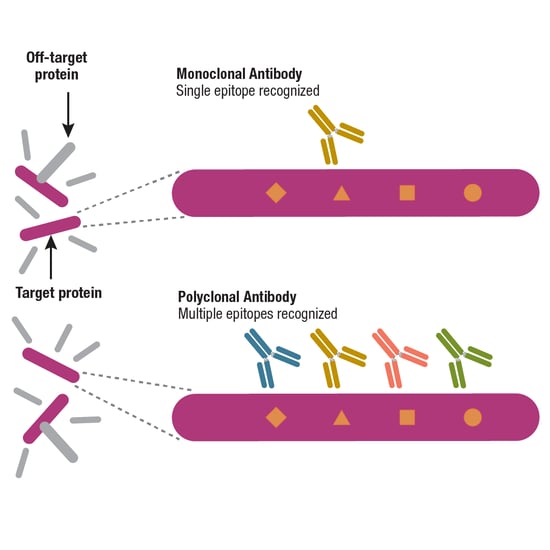
図5:よく検証されたモノクローナル抗体は単一のエピトープを特異的に認識するのに対し、よく検証された選択的なポリクローナル抗体は単一の標的タンパク質に結合します。ただし、そのときにポリクローナル抗体は複数のエピトープを認識しています。
リコンビナント抗体
モノクローナル抗体はさらに、従来法で製造されたか、リコンビナント法で製造されたかで分類することができます。より正確を期するためにリコンビナントモノクローナル抗体の作成と製造の違いを説明します。
動物を用いないハイスループットな抗体の作成法として、ライブラリーのファージディスプレイや酵母ディスプレイをご存知かも知れません。これはリコンビナント抗体の作成と考えることができます。リコンビナントモノクローナル抗体の製造は、in vitroで作成された抗体に限定されないことにご注意ください。動物を免疫して免疫応答とB細胞の増殖を誘導する従来法から始めた場合でも、リコンビナント抗体を製造することができます。成熟B細胞を単離して単一クローンを増殖させた後 (抗体の必須知識Part 4で取り扱います)、重鎖と軽鎖の遺伝子をクローニングしてシーケンシングします。これがリコンビナント抗体の際立った特徴です。抗体の開発者は遺伝子とペプチド配列情報を得て、大規模製造のために培養細胞に抗体を発現させます。リコンビナントモノクローナル抗体は様々な研究用アプリケーションで優先的に選択されることが多く、同じ抗体を継続的に供給することができます。この抗体はロット間の一貫性がより高いことがエンドユーザーにとって重要になります。
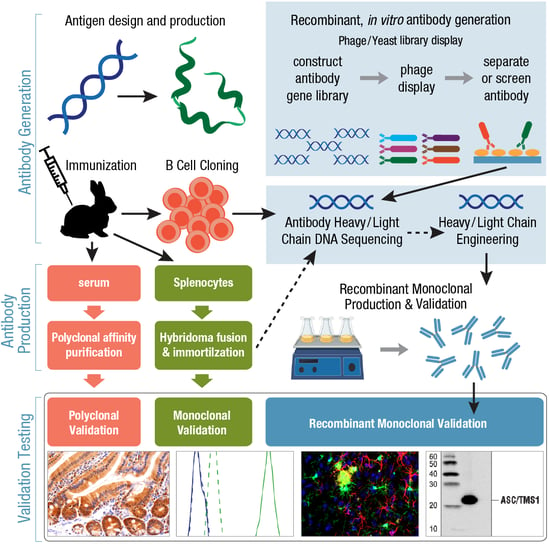
図6:ポリクローナル抗体、モノクローナル抗体、リコンビナントモノクローナル抗体の作成、製造のワークフロー概要
遺伝子配列が決定されており、遺伝子工学的な改変が可能であるため、リコンビナント抗体は治療薬としての応用が進められています。その代表例が抗体薬物複合体の開発です。その他の医療応用には、1) 免疫原性やヒト抗マウス抗体 (HAMA: Human anti-mouse antibody) 反応を低減するための、生物種を変換 (ヒト型化) した抗体の作成、2) 特異性を維持しつつ抗体のサイズを大幅に縮小した単鎖可変断片の作成、3) 同時に異なるエピトープに結合できる二重特異性抗体の作成などが挙げられます。
研究用 (RUO:Research Use Only) 抗体
抗体の重要な分類方法の1つに、どのような場面でその抗体を使用するか、というものがあります。学術研究室に勤務されている方は「RUO (Reaserch use only)」と記載された抗体を使用することが多いと思います。これらは、下で解説する医療用抗体とは異なり、診断を伴わない研究室における実験用途を目的としたものです (図6)。
RUO抗体の検証試験は、標的の生物学的役割に応じて設計し、目的のアプリケーションに適した方法、プロトコール、コントロールを使用する必要があります。例えば、ウェスタンブロットに有効だとされるRUO抗体の場合は、ポジティブコントロールとネガティブコントロールに対する性能を含めた、ウェスタンブロットのアプリケーションに適するという明確な実験的証拠が必要になります。1つのアプリケーションで検証されているからと言って、その抗体が他のアプリケーションでも機能するとは必ずしも言えません。例えば、ウェスタンブロットの検証データが、その抗体が免疫組織化学染色 (IHC) やフローサイトメトリー (IF) などでも機能することを保証することはできません。そのため、抗体を用いるアプリケーションに関連する検証データを確認することが重要です。
参考:検証方法と抗体検証における戦略の詳細はこちら
一般に医療用抗体に比べてRUO抗体に厳しい規制は無く、製造業者による抗体検証のデータが十分であるかの判断は、最終的にその抗体の使用者に委ねられます。不適切に検証された抗体は、抗体再現性の危機に寄与しているため、使用する抗体を信頼できるかどうか、ひいては得られた実験データを自信を持って公表できるかどうか、判断することが重要です。
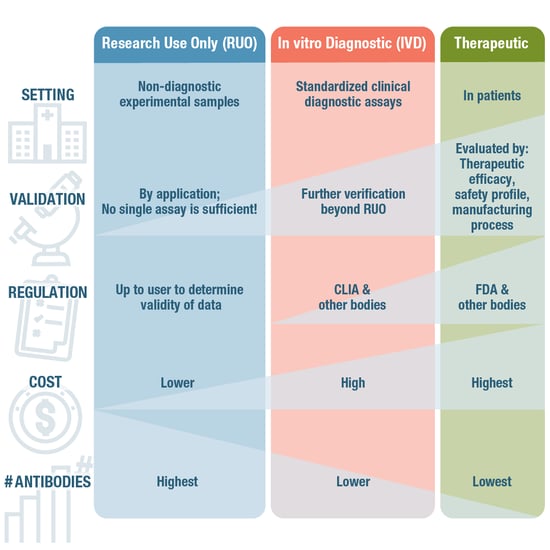
図6:臨床診断や治療を目的とした抗体の認可を得るにはRUO抗体に比べてより厳しい検証基準を満たす必要があります
医療用抗体
RUO抗体とは異なり、医療用抗体は患者に使用することを目的としています。医療用抗体は疾患の治療に利用できる生物学的活性をもつという点で特別です。医療用抗体の作用機序には、リガンドと受容体の相互作用の阻害、シグナル伝達カスケードを遮断、腫瘍細胞を死滅させるための放射線をはじめとした細胞毒性の標的化などがあります。このため、医療用抗体の検証や確認にはここで紹介しているものとは全く異なるアプローチが必要になります。医療用抗体の場合は、ただアプリケーションごとの検証というより、治療効果や安全性プロファイル、製造プロセスによって評価されます。ここでは臨床試験で患者の安全性を保証するため公式のプロセス特性化が使用されます。
米国では、食品医薬品局 (FDA) などの機関によって厳しく規制されています。このような機関は他の医薬品と同様に医療用抗体の認可や却下の権限をもっています。ご想像の通り、医療用抗体を開発してFDAの認可を得るのにかかるコストは、RUO抗体の開発よりはるかに高くなります。
臨床診断用抗体
診断用抗体は臨床の場で患者由来の検体に使用され、RUOλ抗体と医療用抗体の中間に位置づけられます。臨床の場でこれらは病原性感染症、がん、代謝疾患や免疫疾患など、多くの病状を診断するための規格化された検査に不可欠なツールです。IHCやELISAなどの一部の免疫アッセイにはRUO抗体と診断用抗体のどちらを使用することもできますが、臨床診断用には米国の臨床検査改善修正法案 (CLIA: Clinical Laboratory Improvement Amendments) などの管理機関による追加水準の検証と確認が必要です。
要約
以上のように、抗体は製造方法、固有の特性、適した用途によって分類されます。アッセイに最適な抗体を選択する場合、研究や成果発表の目標を達成するために、これら全ての要素を考慮することが必要です。
次回は、抗体技術の歴史と進歩、そして今日の抗体の利用法の選択に与える影響について解説します。 抗体の必須知識Part 3:どのように抗体技術が進歩したかをご覧ください。
抗体の必須知識シリーズをご覧ください:
- 抗体の必須知識 Part 1:抗体の基礎
- 抗体の必須知識Part 2:抗体の多様性と分類
- 抗体の必須知識Part 3:抗体技術の進歩
- 抗体の必須知識Part 4:ポリクローナル抗体とモノクローナル抗体
- 抗体の必須知識Part 5:抗体の選択における重要な検討事項
20-FLE-62535